Создан антибиотик, против которого бактерии бессильны
https://ria.ru/20200603/1572416743.html
Создан антибиотик, против которого бактерии бессильны
Создан антибиотик, против которого бактерии бессильны
Американские ученые обнаружили соединение, которое может стать уникальным препаратом нового поколения, побеждающего даже самые устойчивые к антибиотикам… РИА Новости, 03.06.2020
2020-06-03T18:00
2020-06-03T18:00
2020-06-03T19:51
наука
бактерии
биология
здоровье
открытия — риа наука
принстонский университет
сша
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn25.img.ria.ru/images/151991/70/1519917062_0:3:1036:586_1920x0_80_0_0_66bf81dd518354ea865f3da9aa2c0f2b.jpg
МОСКВА, 3 июн — РИА Новости. Американские ученые обнаружили соединение, которое может стать уникальным препаратом нового поколения, побеждающего даже самые устойчивые к антибиотикам бактерии. Результаты исследования опубликованы в журнале Cell.За последние тридцать лет на рынке не появилось ни одного нового препарата, способного убивать грамотрицательные бактерии. Ключевое их отличие от грамположительных состоит в том, что грамотрицательные бактерии защищены внешним слоем, который оберегает их от большинства антибиотиков.Ученые из Принстонского университета обнаружили соединение SCH-79797, обладающее двойным действием — оно может одновременно прокалывать стенки бактерий и разрушать фолиевую кислоту в их клетках. При этом у бактерий не вырабатывается к нему лекарственной устойчивости.Руководитель исследования, профессор Земером Гитай (Zemer Gitai) сравнивает SCH-79797 с «отравленной стрелой» — комбинацией двух видов оружия — яда и клинка. Оружие, которое одновременно атакует изнутри и снаружи, может уничтожить даже самых сильных противников — от широко распространенной кишечной палочки Escherichia coli до могущественных стафилококка и гонококка, устойчивых ко всем известным антибиотикам. «Это первый антибиотик, который без сопротивления воздействует и на грамположительные и на грамотрицательные бактерии. Мы надеемся, что в будущем это приведет к появлению новых типов антибиотиков», — приводятся в пресс-релизе университета слова Гитая.Основная проблема антибиотиков заключается в том, что бактерии быстро вырабатывают к ним резистентность. Авторы отмечают, что они не наблюдали никакой выработки устойчивости к новому соединению. По их словам, это похоже на мечту — антибиотик, который эффективен против патогенов, не формирует устойчивость и при этом безопасен для людей.»Это действительно выглядит многообещающе, поэтому мы назвали соединение «иррезистин», — говорит ученый.Обычно разработка нового антибактериального препарата происходит следующим образом: ученые находят молекулу, способную убивать бактерии, выращивают несколько поколений микроорганизмов, наблюдая, каким образом патогены вырабатывают к ней устойчивость, а потом редактируют молекулу.Но в данном случае ничего редактировать не пришлось, так как резистентность не вырабатывалась. Но перед авторами встала другая задача: доказать своим коллегам и экспертам, что ни один патоген действительно не может противостоять SCH-79797.Исследователи в течение 25 дней снова и снова подвергали патогены воздействию препарата. Так как у бактерий новое поколение появляется примерно каждые 20 минут, микробы имели миллионы шансов развить резистентность, но они этого не сделали. При этом к другим антибиотикам, которые ученые использовали для сравнения, устойчивость вырабатывалась очень быстро.Для своих опытов ученые даже получили из хранилищ Всемирной организации здравоохранения наиболее устойчивый штамм гонококка Neisseria gonorrhoeae, который входит в топ-5 самых сложных для лечения патогенов. Иррезистин победил и его.»Гонорея представляет собой огромную проблему в плане множественной лекарственной устойчивости, — отмечает Гитай. — У человечества закончились лекарства от гонореи. То, что раньше было последней линией защиты, лекарством в случае чрезвычайной ситуации, теперь не работает».
«Это первый антибиотик, который без сопротивления воздействует и на грамположительные и на грамотрицательные бактерии. Мы надеемся, что в будущем это приведет к появлению новых типов антибиотиков», — приводятся в пресс-релизе университета слова Гитая.Основная проблема антибиотиков заключается в том, что бактерии быстро вырабатывают к ним резистентность. Авторы отмечают, что они не наблюдали никакой выработки устойчивости к новому соединению. По их словам, это похоже на мечту — антибиотик, который эффективен против патогенов, не формирует устойчивость и при этом безопасен для людей.»Это действительно выглядит многообещающе, поэтому мы назвали соединение «иррезистин», — говорит ученый.Обычно разработка нового антибактериального препарата происходит следующим образом: ученые находят молекулу, способную убивать бактерии, выращивают несколько поколений микроорганизмов, наблюдая, каким образом патогены вырабатывают к ней устойчивость, а потом редактируют молекулу.Но в данном случае ничего редактировать не пришлось, так как резистентность не вырабатывалась. Но перед авторами встала другая задача: доказать своим коллегам и экспертам, что ни один патоген действительно не может противостоять SCH-79797.Исследователи в течение 25 дней снова и снова подвергали патогены воздействию препарата. Так как у бактерий новое поколение появляется примерно каждые 20 минут, микробы имели миллионы шансов развить резистентность, но они этого не сделали. При этом к другим антибиотикам, которые ученые использовали для сравнения, устойчивость вырабатывалась очень быстро.Для своих опытов ученые даже получили из хранилищ Всемирной организации здравоохранения наиболее устойчивый штамм гонококка Neisseria gonorrhoeae, который входит в топ-5 самых сложных для лечения патогенов. Иррезистин победил и его.»Гонорея представляет собой огромную проблему в плане множественной лекарственной устойчивости, — отмечает Гитай. — У человечества закончились лекарства от гонореи. То, что раньше было последней линией защиты, лекарством в случае чрезвычайной ситуации, теперь не работает». Исследователи продемонстрировали, что иррезистин эффективно лечит мышей, инфицированных Neisseria gonorrhoeae.
Исследователи продемонстрировали, что иррезистин эффективно лечит мышей, инфицированных Neisseria gonorrhoeae.
https://ria.ru/20200408/1569747118.html
https://ria.ru/20190621/1555750534.html
сша
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2020
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn25.img.ria.ru/images/151991/70/1519917062_127:0:911:588_1920x0_80_0_0_6a6b3734fae0550dcaf1a0551ca3c4e5.jpg
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
бактерии, биология, здоровье, открытия — риа наука, принстонский университет, сша
МОСКВА, 3 июн — РИА Новости. Американские ученые обнаружили соединение, которое может стать уникальным препаратом нового поколения, побеждающего даже самые устойчивые к антибиотикам бактерии. Результаты исследования опубликованы в журнале Cell.
За последние тридцать лет на рынке не появилось ни одного нового препарата, способного убивать грамотрицательные бактерии. Ключевое их отличие от грамположительных состоит в том, что грамотрицательные бактерии защищены внешним слоем, который оберегает их от большинства антибиотиков.
Ученые из Принстонского университета обнаружили соединение SCH-79797, обладающее двойным действием — оно может одновременно прокалывать стенки бактерий и разрушать фолиевую кислоту в их клетках. При этом у бактерий не вырабатывается к нему лекарственной устойчивости.
При этом у бактерий не вырабатывается к нему лекарственной устойчивости.
Руководитель исследования, профессор Земером Гитай (Zemer Gitai) сравнивает SCH-79797 с «отравленной стрелой» — комбинацией двух видов оружия — яда и клинка. Оружие, которое одновременно атакует изнутри и снаружи, может уничтожить даже самых сильных противников — от широко распространенной кишечной палочки Escherichia coli до могущественных стафилококка и гонококка, устойчивых ко всем известным антибиотикам.
«Это первый антибиотик, который без сопротивления воздействует и на грамположительные и на грамотрицательные бактерии. Мы надеемся, что в будущем это приведет к появлению новых типов антибиотиков», — приводятся в пресс-релизе университета слова Гитая.
8 апреля 2020, 14:08НаукаУченые раскрыли, почему стафилоккок больше не лечится антибиотиками
Основная проблема антибиотиков заключается в том, что бактерии быстро вырабатывают к ним резистентность. Авторы отмечают, что они не наблюдали никакой выработки устойчивости к новому соединению. По их словам, это похоже на мечту — антибиотик, который эффективен против патогенов, не формирует устойчивость и при этом безопасен для людей.
«Это действительно выглядит многообещающе, поэтому мы назвали соединение «иррезистин», — говорит ученый.
Обычно разработка нового антибактериального препарата происходит следующим образом: ученые находят молекулу, способную убивать бактерии, выращивают несколько поколений микроорганизмов, наблюдая, каким образом патогены вырабатывают к ней устойчивость, а потом редактируют молекулу.
Но в данном случае ничего редактировать не пришлось, так как резистентность не вырабатывалась. Но перед авторами встала другая задача: доказать своим коллегам и экспертам, что ни один патоген действительно не может противостоять SCH-79797.
Исследователи в течение 25 дней снова и снова подвергали патогены воздействию препарата. Так как у бактерий новое поколение появляется примерно каждые 20 минут, микробы имели миллионы шансов развить резистентность, но они этого не сделали.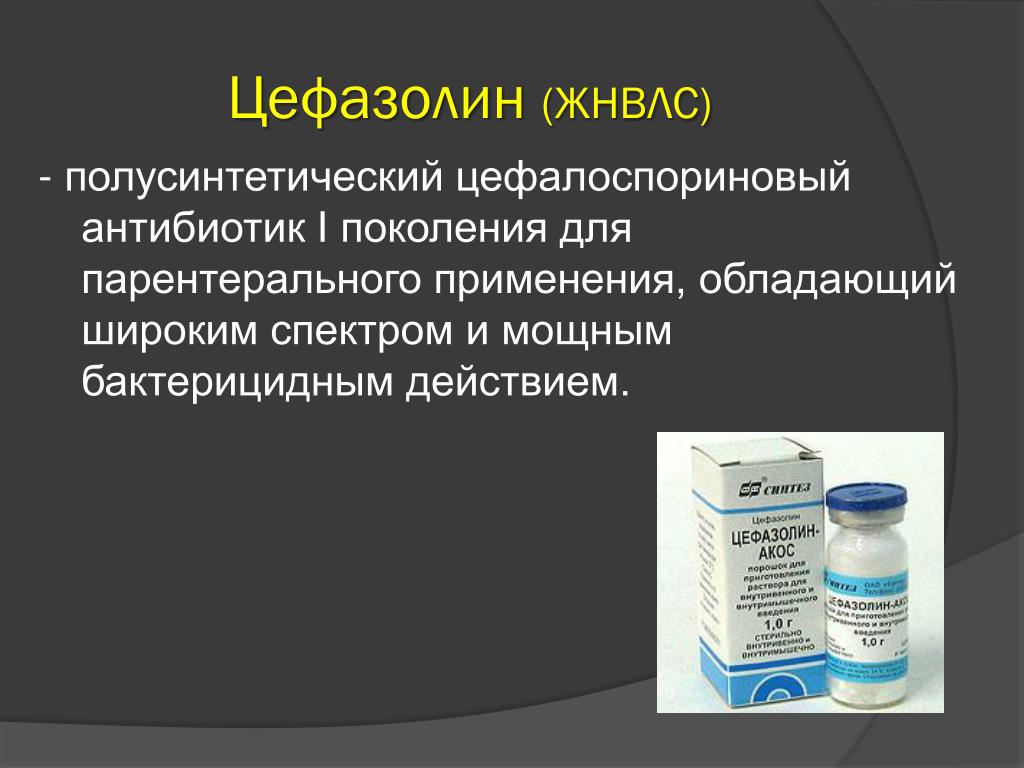 При этом к другим антибиотикам, которые ученые использовали для сравнения, устойчивость вырабатывалась очень быстро.
При этом к другим антибиотикам, которые ученые использовали для сравнения, устойчивость вырабатывалась очень быстро.
Для своих опытов ученые даже получили из хранилищ Всемирной организации здравоохранения наиболее устойчивый штамм гонококка Neisseria gonorrhoeae, который входит в топ-5 самых сложных для лечения патогенов. Иррезистин победил и его.
«Гонорея представляет собой огромную проблему в плане множественной лекарственной устойчивости, — отмечает Гитай. — У человечества закончились лекарства от гонореи. То, что раньше было последней линией защиты, лекарством в случае чрезвычайной ситуации, теперь не работает».
Исследователи продемонстрировали, что иррезистин эффективно лечит мышей, инфицированных Neisseria gonorrhoeae.
21 июня 2019, 08:00НаукаУченые нашли замену антибиотикам
Российские химики нашли вещество для антибиотика нового поколения
https://ria.ru/20200630/1573670834.html
Российские химики нашли вещество для антибиотика нового поколения
Российские химики нашли вещество для антибиотика нового поколения
Биохимики из Московского государственного университета имени М. В. Ломоносова совместно с коллегами из Германии и США открыли механизм воздействия молекулы… РИА Новости, 30.06.2020
2020-06-30T11:44
2020-06-30T11:44
2020-06-30T19:32
наука
биология
российский научный фонд
здоровье
сколковский институт науки и технологий
открытия — риа наука
мгу имени м. в. ломоносова
воз
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn25.img.ria.ru/images/147759/44/1477594436_0:462:5184:3378_1920x0_80_0_0_75b0286fd0009fcfe235e1f81461621b.jpg
МОСКВА, 30 июн — РИА Новости. Биохимики из Московского государственного университета имени М. В. Ломоносова совместно с коллегами из Германии и США открыли механизм воздействия молекулы тетраценомицина на рибосомы, синтезирующие белок у бактерий. Это соединение может стать основой для разработки новых перспективных антибиотиков. Результаты исследования опубликованы в журнале Nature Сhemical Biology.Устойчивость бактерий к антибиотикам — одна из основных проблем современной медицины и здравоохранения, усугубляющаяся из года в год. Резистентность возникает спонтанно вследствие произвольных мутаций или из-за неправильного применения противомикробных препаратов. По данным ВОЗ, все больше инфекций — пневмонию, туберкулез, заражение крови, заболевания пищевого происхождения — становится труднее, а иногда и невозможно вылечить из-за снижения эффективности традиционных антибиотиков, поэтому ученым приходится придумывать что-то новое.Большинство известных антибактериальных препаратов направлено на блокировку самых важных процессов жизнедеятельности бактерий: синтез нуклеиновых кислот, белков и клеточной стенки.Сотрудники химического факультета НИИФХБ имени А. Н. Белозерского и Института функциональной геномики МГУ, Сколтеха, Гамбургского университета и Университета Иллинойса изучили молекулярный механизм воздействия соединения тетраценомицина на рибосомы бактерий, которые отвечают за синтез белка.Тетраценомициновые антибиотики обнаружили более 40 лет назад. Долгое время ученые предполагали, что они работают за счет воздействия на ДНК бактерий. Авторы исследования показали, что тетраценомицин воздействует не на генетический материал клеток, а на большие субъединицы рибосом. По структуре это вещество схоже с группой хорошо изученных антибиотиков тетрациклинов, которые тоже нарушают синтез белка, но связываются совсем с другим участком рибосомы.В то же время оказалось, что молекула тетраценомицина ингибирует трансляцию белков как с бактериальной, так с человеческой рибосомы, то есть этот антибиотик может быть потенциально опасным для человека. Ученые предположили, что модификацией тетраценомицина можно снизить его цитотоксичность.»Наиболее интересный момент — мы нашли новый сайт связывания антибиотика в рибосоме. Поэтому мутации на разных участках рибосом, которые дают устойчивость к другим антибиотикам, не влияют на связывание тетраценомицина, то есть нет кроссрезистентности (устойчивости микроорганизма к антибиотикам близких групп.
Это соединение может стать основой для разработки новых перспективных антибиотиков. Результаты исследования опубликованы в журнале Nature Сhemical Biology.Устойчивость бактерий к антибиотикам — одна из основных проблем современной медицины и здравоохранения, усугубляющаяся из года в год. Резистентность возникает спонтанно вследствие произвольных мутаций или из-за неправильного применения противомикробных препаратов. По данным ВОЗ, все больше инфекций — пневмонию, туберкулез, заражение крови, заболевания пищевого происхождения — становится труднее, а иногда и невозможно вылечить из-за снижения эффективности традиционных антибиотиков, поэтому ученым приходится придумывать что-то новое.Большинство известных антибактериальных препаратов направлено на блокировку самых важных процессов жизнедеятельности бактерий: синтез нуклеиновых кислот, белков и клеточной стенки.Сотрудники химического факультета НИИФХБ имени А. Н. Белозерского и Института функциональной геномики МГУ, Сколтеха, Гамбургского университета и Университета Иллинойса изучили молекулярный механизм воздействия соединения тетраценомицина на рибосомы бактерий, которые отвечают за синтез белка.Тетраценомициновые антибиотики обнаружили более 40 лет назад. Долгое время ученые предполагали, что они работают за счет воздействия на ДНК бактерий. Авторы исследования показали, что тетраценомицин воздействует не на генетический материал клеток, а на большие субъединицы рибосом. По структуре это вещество схоже с группой хорошо изученных антибиотиков тетрациклинов, которые тоже нарушают синтез белка, но связываются совсем с другим участком рибосомы.В то же время оказалось, что молекула тетраценомицина ингибирует трансляцию белков как с бактериальной, так с человеческой рибосомы, то есть этот антибиотик может быть потенциально опасным для человека. Ученые предположили, что модификацией тетраценомицина можно снизить его цитотоксичность.»Наиболее интересный момент — мы нашли новый сайт связывания антибиотика в рибосоме. Поэтому мутации на разных участках рибосом, которые дают устойчивость к другим антибиотикам, не влияют на связывание тетраценомицина, то есть нет кроссрезистентности (устойчивости микроорганизма к антибиотикам близких групп. — Прим. ред.). Открытие нового сайта связывания открывает путь к модификации и улучшению антибиотика», — приводятся в пресс-релизе университета слова первого автора статьи Ильи Остермана, старшего научного сотрудника химического факультета МГУ и главного научного сотрудника Центра наук о жизни Сколтеха.Ароматические поликетиды, к которым относится тетраценомицин, — одна из самых известных групп антибиотиков, открытых в середине ХХ века, широко используемая в медицине наравне с пенициллинами.Один из представителей этого семейства — тетраценомицин X — блокирует синтез белков у бактерий, не обладая при этом перекрестной резистентностью с уже известными ингибиторами синтеза белка, то есть бактериальные штаммы не будут к нему заведомо устойчивы. Изученная молекула обладает важной особенностью. Связывание тетраценомицина с рибосомами происходит по уникальным позициям — нуклеотидным основаниям в белках субъединицы рибосомы, — недоступным для других антибиотиков, что дает хорошие перспективы по преодолению устойчивости к антибиотикам у бактерий. Работа ученых поддержана совместным грантом Российского научного фонда и Немецкого научно-исследовательского сообщества DFG.
— Прим. ред.). Открытие нового сайта связывания открывает путь к модификации и улучшению антибиотика», — приводятся в пресс-релизе университета слова первого автора статьи Ильи Остермана, старшего научного сотрудника химического факультета МГУ и главного научного сотрудника Центра наук о жизни Сколтеха.Ароматические поликетиды, к которым относится тетраценомицин, — одна из самых известных групп антибиотиков, открытых в середине ХХ века, широко используемая в медицине наравне с пенициллинами.Один из представителей этого семейства — тетраценомицин X — блокирует синтез белков у бактерий, не обладая при этом перекрестной резистентностью с уже известными ингибиторами синтеза белка, то есть бактериальные штаммы не будут к нему заведомо устойчивы. Изученная молекула обладает важной особенностью. Связывание тетраценомицина с рибосомами происходит по уникальным позициям — нуклеотидным основаниям в белках субъединицы рибосомы, — недоступным для других антибиотиков, что дает хорошие перспективы по преодолению устойчивости к антибиотикам у бактерий. Работа ученых поддержана совместным грантом Российского научного фонда и Немецкого научно-исследовательского сообщества DFG.
https://ria.ru/20200408/1569747118.html
https://ria.ru/20190621/1555750534.html
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2020
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn23.img.ria.ru/images/147759/44/1477594436_0:0:4608:3456_1920x0_80_0_0_6530108227d7fb9567d18dd4d00a7b38. jpg
jpg
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
биология, российский научный фонд, здоровье, сколковский институт науки и технологий, открытия — риа наука, мгу имени м. в. ломоносова, воз
МОСКВА, 30 июн — РИА Новости. Биохимики из Московского государственного университета имени М. В. Ломоносова совместно с коллегами из Германии и США открыли механизм воздействия молекулы тетраценомицина на рибосомы, синтезирующие белок у бактерий. Это соединение может стать основой для разработки новых перспективных антибиотиков. Результаты исследования опубликованы в журнале Nature Сhemical Biology.Устойчивость бактерий к антибиотикам — одна из основных проблем современной медицины и здравоохранения, усугубляющаяся из года в год. Резистентность возникает спонтанно вследствие произвольных мутаций или из-за неправильного применения противомикробных препаратов. По данным ВОЗ, все больше инфекций — пневмонию, туберкулез, заражение крови, заболевания пищевого происхождения — становится труднее, а иногда и невозможно вылечить из-за снижения эффективности традиционных антибиотиков, поэтому ученым приходится придумывать что-то новое.
Большинство известных антибактериальных препаратов направлено на блокировку самых важных процессов жизнедеятельности бактерий: синтез нуклеиновых кислот, белков и клеточной стенки.
Сотрудники химического факультета НИИФХБ имени А. Н. Белозерского и Института функциональной геномики МГУ, Сколтеха, Гамбургского университета и Университета Иллинойса изучили молекулярный механизм воздействия соединения тетраценомицина на рибосомы бактерий, которые отвечают за синтез белка.
Тетраценомициновые антибиотики обнаружили более 40 лет назад. Долгое время ученые предполагали, что они работают за счет воздействия на ДНК бактерий. Авторы исследования показали, что тетраценомицин воздействует не на генетический материал клеток, а на большие субъединицы рибосом. По структуре это вещество схоже с группой хорошо изученных антибиотиков тетрациклинов, которые тоже нарушают синтез белка, но связываются совсем с другим участком рибосомы.
Авторы исследования показали, что тетраценомицин воздействует не на генетический материал клеток, а на большие субъединицы рибосом. По структуре это вещество схоже с группой хорошо изученных антибиотиков тетрациклинов, которые тоже нарушают синтез белка, но связываются совсем с другим участком рибосомы.
8 апреля 2020, 14:08НаукаУченые раскрыли, почему стафилоккок больше не лечится антибиотиками
В то же время оказалось, что молекула тетраценомицина ингибирует трансляцию белков как с бактериальной, так с человеческой рибосомы, то есть этот антибиотик может быть потенциально опасным для человека. Ученые предположили, что модификацией тетраценомицина можно снизить его цитотоксичность.
«Наиболее интересный момент — мы нашли новый сайт связывания антибиотика в рибосоме. Поэтому мутации на разных участках рибосом, которые дают устойчивость к другим антибиотикам, не влияют на связывание тетраценомицина, то есть нет кроссрезистентности (устойчивости микроорганизма к антибиотикам близких групп. — Прим. ред.). Открытие нового сайта связывания открывает путь к модификации и улучшению антибиотика», — приводятся в пресс-релизе университета слова первого автора статьи Ильи Остермана, старшего научного сотрудника химического факультета МГУ и главного научного сотрудника Центра наук о жизни Сколтеха.
Ароматические поликетиды, к которым относится тетраценомицин, — одна из самых известных групп антибиотиков, открытых в середине ХХ века, широко используемая в медицине наравне с пенициллинами.
Один из представителей этого семейства — тетраценомицин X — блокирует синтез белков у бактерий, не обладая при этом перекрестной резистентностью с уже известными ингибиторами синтеза белка, то есть бактериальные штаммы не будут к нему заведомо устойчивы.
Изученная молекула обладает важной особенностью. Связывание тетраценомицина с рибосомами происходит по уникальным позициям — нуклеотидным основаниям в белках субъединицы рибосомы, — недоступным для других антибиотиков, что дает хорошие перспективы по преодолению устойчивости к антибиотикам у бактерий.
Работа ученых поддержана совместным грантом Российского научного фонда и Немецкого научно-исследовательского сообщества DFG.21 июня 2019, 08:00НаукаУченые нашли замену антибиотикам
Новые препараты 2020 года в медицине
Обзор 18 новейших антибактериальных препаратов в мировой практике
Одним из величайших достижений медицинской науки XX в. является открытие и внедрение в клиническую практику антибиотиков, «победа над микроорганизмами при помощи их же оружия». Однако, фактически использование антибактериальных средств вылилось в затяжное противостояние между человечеством и микромиром. Бесконтрольное увлечение антибиотиками, от применения в животноводстве для быстрого набора веса скотом до бытового «поедания» этих препаратов при любом насморке, способствует распространению полирезистентных штаммов бактерий. Несмотря на умение микроорганизмов приспосабливаться к препаратам, ученые не опускают рук. С 2010 года по сегодняшний день в клиническую практику введено 18 новых антибактериальных препаратов и их комбинаций (некоторые — только в стране-производителе). Один из этих препаратов разработан и используется в РФ, а еще семь — зарегистрированы для использования в нашей стране. Предлагаем вам обзор 10 наиболее интересных из них. Остальные 8 мы упомянем лишь вскользь. Стоит помнить, что большинство указанных в статье ЛС — это препараты резерва для клинической терапии, не подходящие для бытового применения.
Цефтазидим/авибактам, одобрен Управлением по контролю за продуктами и лекарствами США (FDA; Food and Drug Administration) в 2015 г., в РФ зарегистрирован с мая 2017 г.
Цефтазидим, цефалоспорин III поколения — препарат широкого спектра, нарушает формирование клеточной стенки бактерий через пенициллинсвязывающие белки и индуцирует ее повреждение путем активации аутолитических ферментов. Основное значение имеет активность этого антибиотика против таких грамотрицательных микроорганизмов, как Pseudomonas aeruginosa, Klebsiella spp, Escherichia coli и Enterobacter spp. Внутрибольничные штаммы перечисленных бактерий всё чаще продуцируют расширенный спектр β-лактамаз — ферментов, нейтрализующих цефалоспорины. Новый антибиотик решает эту проблему при помощи ингибитора β-лактамаз авибактама, восстанавливающего чувствительность к цефтазидиму. Авибактам инактивирует β-лактамазы класса А (в том числе карбопенемазы Klebsiella pneumoneae), а также С и D, резистентных к клавулановой кислоте и тазобактаму.
Внутрибольничные штаммы перечисленных бактерий всё чаще продуцируют расширенный спектр β-лактамаз — ферментов, нейтрализующих цефалоспорины. Новый антибиотик решает эту проблему при помощи ингибитора β-лактамаз авибактама, восстанавливающего чувствительность к цефтазидиму. Авибактам инактивирует β-лактамазы класса А (в том числе карбопенемазы Klebsiella pneumoneae), а также С и D, резистентных к клавулановой кислоте и тазобактаму.
При этом авибактам не эффективен против β-лактамаз класса B. По результатам исследования REPRISE, опубликованного в 2016 г. и включавшего пациентов с внутрибольничными инфекциями из 16 стран, 9 % больных оказались резистентными к терапии цефтазидимом/авибактамом.
Показания для применения цефтазидима/авибактама: осложненные интраабдоминальные инфекции, осложненные инфекции мочевыводящих путей, госпитальная пневмония (в том числе ИВЛ-ассоциированная), а также инфекции, вызванные полирезистентными грамотрицательными микроорганизмами при ограниченных возможностях терапии [1, 2].
Аналогичный подход к преодолению резистентности — комбинация известного антибиотика с очередным ингибитором β-лактамаз — реализован в препарате меропенем/ваборбактам (одобрен FDA в августе 2017 г., в РФ не зарегистрирован).
Цефтолозан/тазобактам, одобрен FDA в 2014 г., в РФ зарегистрирован с ноября 2018 г.
Цефтолозан — новый цефалоспорин V поколения. В отличие от предыдущего препарата, направлен в основном против P. aeruginosa. Благодаря более тяжелой боковой цепи цефтолозан малочувствителен к β-лактамазам класса С, а благодаря очень прочному связыванию с пенициллинсвязывающими белками не подвержен активному эффлюксу (выведению из бактериальной клетки) и не чувствителен к утере бактериями пориновых каналов, через которые проникает ряд других антибиотиков.
Тазобактам дополнительно инактивирует часть β-лактамаз класса А (но не карбапенемазы).
Показания к применению цефтолозана/тазобактама: осложненные интраабдоминальные инфекции, осложненные инфекции мочевыводящих путей [3].
Также ранее был зарегистрирован еще один цефалоспорин V поколения (FDA — 2010 г, РФ — 2012 г.) — цефтаролина фосамил. Обладает широким спектром действия как против внебольничных грампозитивных (включая метициллинрезистентные штаммы S. aureus), так и против грамнегативных микроорганизмов.
Далбаванцин, одобрен FDA в 2014 г., в РФ зарегистрирован в 2017 г.
Представитель класса полусинтетических липогликопептидов (гликопептидов с присоединенной липофильной боковой цепью), логическое «продолжение» ванкомицина, используемого с 1958 г. Как и предшественник, далбаванцин связывается с пептидогликанами в процессе синтеза клеточной стенки бактерий и нарушает его.
Препарат активен в отношении MRSA и метициллинрезистентного Staphylococcus epidermidis (MRSE), а также некоторых других стрептококков и энтерококков. Клинически значимой активности против грамнегативных бактерий не имеет. По данным исследований, показал сходную эффективность с комбинацией ванкомицин/линезолид в терапии инфекций кожи, но отличается удобством применения: две инъекции раз в неделю против двух инъекций в сутки в течение тех же двух недель.
Показания к применению далбаванцина: острые бактериальные инфекции кожи и мягких тканей [9].
Другой липогликопептид, оритаванцин (одобрен FDA в 2014 г., в РФ не зарегистрирован) обладает сходными с далбаванцином характеристиками, назначается по тем же показаниям, но вводится однократно.
Тедизолид, одобрен FDA в 2014 г., в РФ зарегистрирован в 2016 г.
Препарат класса оксазолидинонов II поколения. Оксазолидиноны — синтетические антибактериальные препараты, в основе которых лежит кольцевая молекула 2‑оксазолидона. Тедизолид — «потомок» хорошо зарекомендовавшего себя линезолида, впервые выпущенного в 2000 году.
Тедизолид — «потомок» хорошо зарекомендовавшего себя линезолида, впервые выпущенного в 2000 году.
Эффективен против широкого спектра грампозитивных бактерий, в том числе MRSA, различных стрептококков и энтерококков (в том числе ванкомицинрезистентных; VRE). Малоактивен в отношении грамнегативных бактерий.
Механизм действия: нарушает синтез бактериальных белков уже на этапе создания рибосомы, связываясь с ее 50S субъединицей. В целом, по данным многочисленных сравнительных исследований, не всегда и не значительно превосходит по эффективности линезолид, при этом у последнего значительно больше показаний к применению.
Показания к применению тедизолида: острые бактериальные инфекции кожи и мягких тканей [10, 11].
Тиоуреидоиминометилпиридиния перхлорат, зарегистрирован в РФ в 2012 г.
Единственное в списке отечественное антибактериальное средство, допущено к применению также только в РФ. Это синтетический противотуберкулезный препарат, механизм действия которого окончательно не установлен. Также нет результатов контролируемого исследования с большим числом пациентов.
По предварительным данным, тиоуреидоиминометилпиридиния перхлорат увеличивает частоту прекращения бактериального выделения (основной критерий эффективности терапии) у пациентов с резистентным туберкулезом [12, 13].
Бедаквилин, одобрен FDA в 2012 г., в РФ зарегистрирован в 2013 г.
Противотуберкулезный препарат, первое вещество, относящееся к новой группе антибактериальных препаратов — диарилхинолинам. Блокирует протонную помпу АТФ-синтазы микобактерий, нарушая выработку энергии для всех процессов в бактериальной клетке.
Эффективен в случаях туберкулеза со множественной лекарственной устойчивостью (к изониазиду и рифампицину) и широкой лекарственной устойчивостью микобактерий (к препаратам II линии и фторхинолонам), рекомендован ВОЗ в качестве препарата «последнего резерва». Не рекомендуется для повседневного использования [13, 14].
Не рекомендуется для повседневного использования [13, 14].
За эти годы был зарегистрирован и третий противотуберкулезный препарат, деламанид (Европейское агентство лекарственных средств — 2014 г., РФ — 2017 г.). Вещество ингибирует синтез метоксимиколевой кислоты и кетомиколевой кислоты, компонентов клеточной стенки микобактерий. Также показан к применению лишь в случаях активного туберкулеза со множественной лекарственной устойчивостью [13, 15].
Фидаксомицин, одобрен FDA в 2011 г., в РФ не зарегистрирован.
Первый представитель класса макроциклических антибиотиков, узкоспециализированный препарат. Выпускается в форме таблеток, всасывается минимально, а свои эффекты реализует в просвете кишечника, где обитает его единственная мишень — Clostridium difficile (возбудитель псевдомембранозного колита, — прим. ред.). Фидаксомицин нарушает транскрипцию бактериальной РНК. На несколько процентов более эффективен по сравнению с традиционно использующимися метронидазолом и ванкомицином, выгодно отличается от них меньшим количеством рецидивов, однако в сотни раз дороже обоих: стоимость курса составляет около $ 4000.
Показания для применения фидаксомицина: Cl. difficile-ассоциированная диарея, псевдомембранозный колит [4].
Делафлоксацин, одобрен FDA в 2017 г., в РФ не зарегистрирован.
Как и другие фторхинолоны, делафлоксацин нарушает репликацию ДНК и деление клеток, связывая ферменты ДНК-гиразу и топоизомеразу IV. Благодаря изменениям в структуре молекулы, от других препаратов группы отличается более высокой активностью в кислой среде, часто сопутствующей очагам инфекции, а также эффективностью против метициллинрезистентного S. aureus (MRSA). Активен и против ряда других грамположительных и — в меньшей степени — грамотрицательных бактерий.
Показания к применению делафлоксацина: острые бактериальные инфекции кожи и мягких тканей. Также препарат на данный момент проходит III фазу испытаний при внебольничной пневмонии [5].
Также препарат на данный момент проходит III фазу испытаний при внебольничной пневмонии [5].
Стоимость курса терапии — около $ 1500.
В 2014 г. FDA зарегистрировало фторхинолон для местного применения финафлоксацин. Он показан для лечения наружного отита при высевании P. aeruginosa или S. aureus. В декабре 2017 г. FDA также допустило к использованию нефторированный хинолон озеноксацин в форме крема для лечения импетиго — кожной инфекций, вызываемой S. aureus или Streptococcus pyogenes. Оба препарата в РФ не зарегистрированы.
Нефторированный хинолон немоноксацин, разработанный, выпускаемый и используемый на Тайване с 2014 г. для лечения острых бактериальных инфекций кожи и мягких тканей, а также внебольничной пневмонии, широкого международного признания пока не получил [6–8].
Плазомицин, одобрен FDA в июне 2018 г., в РФ не зарегистрирован.
Новый антибиотик-аминогликозид (так называемый «неогликозид»). Связывается с 30S субъединицей рибосомы, блокируя синтез бактериальных белков.
Активен в отношении многих аэробных грамнегативных бактерий, в том числе Enterobacteriaceae, продуцирующих β-лактамазы широкого спектра, карбапенемрезистентных энтеробактерий, а также микроорганизмов, продуцирующих аминогликозид-модифицирующие ферменты.
Показания к применению плазомицина: осложненные инфекции мочевыводящих путей, включая пиелонефрит.
Стоимость курса терапии, в зависимости от веса пациента и продолжительности лечения, — около $ 3300–4000 [16].
Рибосомы — мелкие клеточные органеллы, которые «собирают» белок из отдельных аминокислот. Состоят из двух субъединиц, большой и малой, которые различают по скорости осаждения при центрифугировании (чем больше размер, тем быстрее осаждение). Размеры большой и малой субъединиц у бактерий — 50S и 30S, у высших животных — 60S и 40S. Соответственно, препараты, блокирующие синтез белка бактерий, теоретически безопасны для рибосом человека.
Соответственно, препараты, блокирующие синтез белка бактерий, теоретически безопасны для рибосом человека.
Эравациклин, одобрен FDA в августе 2018 г., в РФ не зарегистрирован.
Синтетический тетрациклин, сходный по структуре с тигециклином, принятым к использованию еще в 2005 году. Эравациклин связывается с 30S субъединицей рибосом, блокируя присоединение аминокислоты и нарушая синтез белка. В отличие от предыдущих тетрациклинов, структурно защищен от активного эффлюкса и обходит бактериальную «защиту рибосом».
Антибиотик широкого спектра действия, к нему чувствительны грампозитивные S. aureus, включая MRSA, Streptococcus pneumoniae, энтерококки (в том числе ванкомицинрезистентные), а также грамнегативные бактерии: Acinetobacter baumannii, Haemophilus influenzae, Enterobacteriaceae, в ключая карбапенем-резистентные штаммы, и др.
Показания к применению эравациклина: осложненные интраабдоминальные инфекции [17].
Стоимость курса терапии сравнительно невысока — около $ 630–2000 за курс, в зависимости от веса пациента и продолжительности лечения.
Последний зарегистрированный на сегодняшний день антибиотик, омадациклин (одобрен FDA в октябре 2018 г., в РФ не зарегистрирован), также относится к тетрациклинам. Механизм действия и спектр активности сходен с эравациклином, но показания другие: внебольничная пневмония и острые бактериальные инфекции кожи и мягких тканей. Стоимость курса — более $ 3500 [18].
Источники
- Mosley JF 2nd, Smith LL, Parke CK, et al. Ceftazidime-Avibactam (Avycaz): For the Treatment of Complicated Intra-Abdominal and Urinary Tract Infections. P T. 2016; 41 (8):4 79–83. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4959616/
- Carmeli Y, Armstrong J, Laud PJ, et al. Ceftazidime-avibactam or best available therapy in patients with ceftazidime-resistant Enterobacteriaceae and Pseudomonas aeruginosa complicated urinary tract infections or complicated intra-abdominal infections (REPRISE): a randomised, pathogen-directed, phase 3 study.
 Lancet Infect Dis. 2016; 16: 661-673. https://www.thelancet.com/journals/laninf/article/PIIS1473-3099(16)30004-4/fulltext
Lancet Infect Dis. 2016; 16: 661-673. https://www.thelancet.com/journals/laninf/article/PIIS1473-3099(16)30004-4/fulltext - Hong MC, Hsu DI, Bounthavong M. Ceftolozane/tazobactam: a novel antipseudomonal cephalosporin and β-lactamase-inhibitor combination. Infect Drug Resist. 2013; 6: 215–23. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3848746/
- Zhanel GG, Walkty AJ, Karlowsky JA. Fidaxomicin: A novel agent for the treatment of Clostridium difficile infection. Can J Infect Dis Med Microbiol. 2015; 26 (6): 305–12. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4692299/
- Jorgensen SCJ, Mercuro NJ, Davis SL, Rybak MJ. Delafloxacin: Place in Therapy and Review of Microbiologic, Clinical and Pharmacologic Properties. Infect Dis Ther. 2018; 7 (2): 197–217. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5986682/
- Finafloxacin otic (Rx). Medscape. https://reference.medscape.com/drug/xtoro-finafloxacin-otic-999986
- Rosen T, Albareda N, Rosenberg N, et al. Efficacy and Safety of Ozenoxacin Cream for Treatment of Adult and Pediatric Patients With Impetigo: A Randomized Clinical Trial. JAMA Dermatol. 2018; 154 (7): 806–813. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6128489/
- Qin X, Huang H. Review of nemonoxacin with special focus on clinical development. Drug Des Devel Ther. 2014; 8: 765–74. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4094567/
- Smith JR, Roberts KD, Rybak MJ. Dalbavancin: A Novel Lipoglycopeptide Antibiotic with Extended Activity Against Gram-Positive Infections. Infect Dis Ther. 2015; 4 (3): 245–58. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4575294/
- Rybak JM, Roberts K. Tedizolid Phosphate: a Next-Generation Oxazolidinone. Infect Dis Ther. 2015 r; 4 (1): 1–14. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4363212/
- Дмитриева Н.В., Петухова И.Н., Григорьевская З.
 В., Багирова Н.С., Терещенко И.В. Сравнение клинической активности двух оксазолидинов – линезолида и тедизолида: неоправданные ожидания. Сибирский онкологический журнал. 2018; 17 (5): 87–93.
В., Багирова Н.С., Терещенко И.В. Сравнение клинической активности двух оксазолидинов – линезолида и тедизолида: неоправданные ожидания. Сибирский онкологический журнал. 2018; 17 (5): 87–93. - Перхлозон®. Фармасинтез. https://pharmasyntez.com/products/protivotyberkyleznie-preparati/perkhlozon/?type=specialist
- Зеллвегер Ж.-П. Зеллвегер Ж.-П. Современные возможности лечения туберкулеза со множественной лекарственной устойчивостью микобактерий // BISSA. 2017. №4. С.5–12. https://cyberleninka.ru/article/n/sovremennye-vozmozhnosti-lecheniya-tuberkuleza-so-mnozhestvennoy-l…
- Pym AS, Diacon AH, Tang SJ, et al. Bedaquiline in the treatment of multidrug- and extensively drug-resistant tuberculosis. Eur Respir J. 2016; 47 (2): 564–74. https://erj.ersjournals.com/content/47/2/564.long
- Xavier AS, Lakshmanan M. Delamanid: A new armor in combating drug-resistant tuberculosis. J Pharmacol Pharmacother. 2014; 5 (3): 222–4. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4156838/
- Shaeer KM, Zmarlicka MT, Chahine EB, Piccicacco N, Cho JC. Plazomicin: A Next-Generation Aminoglycoside. Pharmacotherapy. 2019; 39 (1): 77–93. https://accpjournals.onlinelibrary.wiley.com/doi/full/10.1002/phar.2203
- FDA Approves New Antibacterial Eravacycline (Xerava). Medscape. https://www.medscape.com/viewarticle/901305
- Omadacycline (Rx). Medscape. https://reference.medscape.com/drug/nuzyra-omadacycline-1000262
Химики нашли кандидата в антибиотики нового поколения
Биохимики МГУ совместно с коллегами из Германии и США открыли механизм воздействия молекулы тетраценомицина на рибосомы клеток человека и бактерий. Исследованное соединение может стать основой перспективных антибиотиков. Работа ученых опубликована в престижном журнале Nature Сhemical Biology 29 июня 2020 года.
Устойчивость к антибиотикам является одной из наиболее серьезных угроз для здоровья человечества, продовольственной безопасности и развития мировой экономики. Резистентность к препаратам у микроорганизмов может появляться спонтанно вследствие произвольных мутаций или из-за неправильного применения противомикробных препаратов. По данным ВОЗ, все больше инфекций — например, пневмонию, туберкулез, заражение крови, заболевания пищевого происхождения — становится труднее, а иногда и невозможно вылечить из-за снижения эффективности антибиотиков.
Резистентность к препаратам у микроорганизмов может появляться спонтанно вследствие произвольных мутаций или из-за неправильного применения противомикробных препаратов. По данным ВОЗ, все больше инфекций — например, пневмонию, туберкулез, заражение крови, заболевания пищевого происхождения — становится труднее, а иногда и невозможно вылечить из-за снижения эффективности антибиотиков.
Большинство известных антибиотиков действуют по трем механизмам: нарушение синтеза клеточной стенки, нуклеиновых кислот или белка. Более половины известных антибиотиков нарушают синтез белка рибосомами. Биохимики и специалисты в области медицинской химии пытаются обнаружить перспективные антибиотики среди ингибиторов рибосом.
Сотрудники химического факультета, НИИФХБ имени А.Н. Белозерского и Института функциональной геномики МГУ, Сколтеха, Гамбургского университета (ФРГ), Университета Иллинойса (США) изучили молекулярный механизм воздействия соединения тетраценомицина на рибосомы бактерий и человека. Тетраценомициновые антибиотики были обнаружены более 40 лет назад. Долгое время ученые предполагали, что их антибиотическое воздействие вызвано воздействием на ДНК бактерий. Российские биохимики и зарубежные коллеги показали, что тетраценомицин воздействует на большие субъединицы рибосом, а не на генетический материал клеток. Вместе с тем, молекула тетраценомицина ингибирует трансляцию белков как с бактериальной, так с человеческой рибосом, и если может быть антибиотиком, то потенциально опасным для человека. Ученые полагают, что модификацией тетраценомицина можно снизить его цитотоксичность. Изученная молекула обладает важной особенностью: связывание тетраценомицина с рибосомами происходит по уникальным позициям (нуклеотидным основаниям в белках субъединицы рибосомы), недоступным для других антибиотиков. По структуре тетраценомицин схож с группой хорошо изученных антибиотиков тетрациклинов, которые тоже нарушают синтез белка, но связываются совсем с другим участком рибосомы.
«Наиболее интересный момент — мы нашли новый сайт связывания антибиотика в рибосоме. Поэтому мутации на разных участках рибосом, которые дают устойчивость к другим антибиотикам, не влияют на связывание тетраценомицина, то есть нет кроссрезистентности [прим. – устойчивости микроорганизма к антибиотикам близких групп]. Открытие нового сайта связывания открывает путь к модификации и улучшению антибиотика», — прокомментировал один из авторов исследования, старший научный сотрудник химического факультета МГУ, главный научный сотрудник Центра наук о жизни Сколтеха Илья Остерман.
Работа ученых поддержана совместным грантом Российского научного фонда и Немецкого научно-исследовательского сообщества (DFG).
Найден потенциальный антибиотик нового поколения
Исследователи из России, Германии и США выяснили, как тетраценомицин действует на рибосомы клеток человека и бактерий. Новое соединение может стать основой перспективных антибиотиков. Статья об открытии опубликована в журнале Nature Сhemical Biology.
Антибиотикорезистентность может возникать у микроорганизмов спонтанно из-за произвольных мутаций или неправильного применения противомикробных препаратов. Согласно ВОЗ, лечение все большего количества инфекций, включая пневмонию, туберкулез и заражение крови, становится осложнено резистентностью микроорганизмов к антибиотикам.
Большая часть веществ этого класса использует всего три механизма: нарушение процессов образования клеточной стенки, нуклеиновых кислот или белков. Больше половины известных антибиотиков нарушают синтез белка рибосомами. Поэтому сегодня исследователи стараются найти противомикробные препараты среди ингибиторов рибосом.
Исследователи НИИФХБ имени А. Н. Белозерского и Института функциональной геномики МГУ, Сколтеха, Гамбургского и Иллинойсского университетов проанализировали, как тетраценомицин действует на рибосомы бактерий и человека. Тетраценомициновые антибиотики были обнаружены более 40 лет назад, и довольно долго ученые предполагали, что их противомикробные свойства связаны с воздействием на ДНК бактерий. Новое исследование показало, что тетраценомицин действует на большие субъединицы рибосом, а не на генетический материал клеток.
Новое исследование показало, что тетраценомицин действует на большие субъединицы рибосом, а не на генетический материал клеток.
Кроме того, авторы показали, что молекула тетраценомицина ингибирует трансляцию белков как с бактериальной, так с человеческой рибосом. Это значит, что если соединение и может быть антибиотиком, то потенциально опасным для человека. Ученые предполагают, что это соединение можно модифицировать и снизить цитотоксичность. Исследователи показали, что связывание тетраценомицина с рибосомами происходит по уникальным позициям, которые недоступны для других групп антибиотиков. По структуре тетраценомицин похож на представителей группы тетрациклинов, которые тоже нарушают синтез белка, но связываются совсем с другим участком рибосомы.
АВЕЛОКС: Новый антибактериальный препарат широкого спектра действия
НОВЫЙ АНТИБАКТЕРИАЛЬНЫЙ ПРЕПАРАТ ШИРОКОГО СПЕКТРА ДЕЙСТВИЯ
Фторхинолоны относительно недавно применяются в клинической практике. Эти препараты характеризуются широким спектром антимикробной активности и благоприятными фармакокинетическими свойствами. Первые препараты этой группы (ципрофлоксацин, офлоксацин, пефлоксацин) достаточно широко используют в клинике при различных инфекциях — мочевыводящих путей, кожи и мягких тканей, интраабдоминальных и малого таза, кишечных, при пневмонии, сепсисе, гонорее. Однако недостатком ранних фторхинолонов является невысокая активность в отношении грамположительных бактерий, прежде всего пневмококков и стрептококков, что ограничивает их применение при внебольничных инфекциях дыхательных путей.
За последние 5 лет созданы и интенсивно изучаются в клинике препараты нового поколения фторхинолонов, характеризующиеся повышенной активностью в отношении грамположительных микроорганизмов. Первым препаратом нового поколения фторхинолонов является спарфлоксацин, однако его использование лимитировано проблемами переносимости (фототоксичность, удлинение интервала Q–T). Кроме того, в настоящее время стали доступными другие препараты, превосходящие его по уровню активности. К ним относятся несколько соединений, находящихся на разных фазах клинических исследований: моксифлоксацин, гатифлоксацин, гемифлоксацин, клинафлоксацин, ситафлоксацин.
Кроме того, в настоящее время стали доступными другие препараты, превосходящие его по уровню активности. К ним относятся несколько соединений, находящихся на разных фазах клинических исследований: моксифлоксацин, гатифлоксацин, гемифлоксацин, клинафлоксацин, ситафлоксацин.
Моксифлоксацин (АВЕЛОКС производства «Байер АГ») характеризуется широким антимикробным спектром (грамположительные и грамотрицательные аэробные бактерии и анаэробы, атипичные микроорганизмы), благоприятными фармакокинетическими свойствами (высокая биодоступность, хорошее проникновение в ткани, длительный период полувыведения), что позволяет применять препарат 1 раз в сутки, хорошей переносимостью и отсутствием серьезных нежелательных явлений, в отличие от других фторхинолонов (фототоксичность, гепатотоксичность, судороги, удлинение интервала?Q–T).
АНТИМИКРОБНАЯ АКТИВНОСТЬ
Механизм действия моксифлоксацина связан с ингибированием ДНК-гиразы — основного фермента бактериальной клетки, ответственного за процесс нормального биосинтеза ДНК. Препарат характеризуется высокой бактерицидной активностью (Boswell F.J. et al., 1999), при этом бактерицидный эффект проявляется на уровне минимальных подавляющих концентраций (МПК) или при концентрациях, превышающих МПК в 2–4 раза (Speciale A. et al., 1999). Моксифлоксацин обладает клинически значимым постантибиотическим эффектом (в отношении S. pneumoniae — 1,25–2 ч, S. aureus — 2 ч, E. coli — 0,35–1,75 ч, K.pneumoniae — 0,5–1,75 ч) (Boswell F.J. et al., 1999; Maggiolo F. et al., 2000).
АВЕЛОКС обладает широким спектром антимикробной активности, сопоставимым с таковым других фторхинолонов. В отличие от ранних фторхинолонов моксифлоксацин более активен в отношении грамположительных бактерий, анаэробов и атипичных внутриклеточных микроорганизмов. Штаммы микроорганизмов с МПК Ј2 мг/л рассматриваются как чувствительные к моксифлоксацину, штаммы с МПК і4 мг/л — как устойчивые.
Сравнительная активность в отношении респираторных патогенов.
Невысокая природная активность ранних фторхинолонов (ципрофлоксацина, офлоксацина, пефлоксацина) в отношении наиболее частых возбудителей внебольничных инфекций дыхательных путей (пневмококков, стрептококков, стафилококков и атипичных микробов) ограничивала их применение при этих заболеваниях. В настоящее время стандартными антибиотиками при внебольничных инфекциях дыхательных путей считаются пенициллины (амоксициллин, амоксициллин/клавуланат) и цефалоспорины II поколения. К их недостаткам следует отнести отсутствие активности в отношении атипичных возбудителей и снижение к ним чувствительности пневмококков. В этой связи вызывают интерес фторхинолоны нового поколения с наиболее сбалансированным спектром антимикробной активности при внебольничных инфекциях дыхательных путей.
АВЕЛОКС среди всех приведенных препаратов наиболее активен в отношении штаммов пневмококков со сниженной чувствительностью к пенициллину, а также стафилококков, гемофильной палочки, клебсиеллы и атипичных микроорганизмов. Уровень концентраций моксифлоксацина в крови и тканях превышает МПК основных возбудителей инфекций дыхательных путей в течение всего периода лечения, что определяет высокую эффективность препарата (MacGowan A.P., 1999; Schentag J., 1999; Turnidge J., 1999; Read R.C., 2000). Таким образом, моксифлоксацин — один из наиболее перспективных препаратов при внебольничных инфекциях дыхательных путей.
КЛИНИЧЕСКАЯ ЭФФЕКТИВНОСТЬ
Клиническая эффективность АВЕЛОКСА к настоящему времени изучена при внебольничных инфекциях дыхательных путей (пневмония, бронхит, синусит) в сравнительных контролируемых исследованиях. Кроме того, имеются два сообщения об эффективности моксифлоксацина при инфекциях кожи и мягких тканей. Исследования клинической эффективности моксифлоксацина при инфекциях дыхательных путей перечислены в таблице. Во всех исследованиях моксифлоксацин применяли в дозе 400 мг 1 раз в сутки.
Во всех исследованиях моксифлоксацин применяли в дозе 400 мг 1 раз в сутки.
Таблица Результаты контролируемых сравнительных клинических исследований моксифлоксацина при внебольничных инфекциях дыхательных путей |
Ссылка, дизайн | Диагноз | Число | Препарат | Доза (г), крат- (в сутки) | Длитель- | Эффективность, % | Нежелатель- | Заключение | |
клиничес- | бактериоло- | ||||||||
Fogarty C. et al. (1999) | Пневмония | 194 | Моксифлоксацин | 0,4 х 1 | 10 | 95 | 94 | 35 | Мокси=Клар |
188 | Кларитромицин | 0,5 х 2 | 10 | 95 | 93 | 34 | |||
Мохов О. | Пневмония | 16 | Моксифлоксацин | 0,4 х 1 | 10 | 94 | 89 | 38 | Мокси=Амокс |
ДС, МЦ | ? | 19 | Амоксициллин | 1 х 3 | 10 | 95 | 80 | 58 | ? |
Hoffken G. et al. (1999) | Пневмония | 180 | Моксифлоксацин | 0,2 х 1 | 10 | 91 | 91 | ? | КЭ: Мокси=Клар |
ДС, МЦ | ? | 177 | Моксифлоксацин | 0,4 х 1 | 10 | 93 | 90 | ** | БЭ: Мокси>Клар |
? | ? | 174 | Кларитромицин | 0,5 х 2 | 10 | 92 | 85 | ? | ? |
Patel T. | Пневмония | 196 | Моксифлоксацин | 0,4 х 1 | 10 | 93 | 91 | 33 | ? |
Chodosh S. et al. | Хронический | 143 | Моксифлоксацин | 0,4 х 1 | 5 | 89 | 89 | 26 | Мокси |
(2000) | бронхит | 148 | Моксифлоксацин | 0,4 х 1 | 10 | 91 | 91 | 30 | (5 или 10 дней)= |
ДС, МЦ? | ? | 129 | Кларитромицин | 0,5 х 2 | 10 | 91 | 85 | 33 | Клар (10 дней) |
Wilson R. | Хронический | 322 | Моксифлоксацин | 0,4 х 1 | 5 | 89 | 77*** | 21 | КЭ: Мокси=Клар БЭ: |
ДС, МЦ | бронхит | 327 | Кларитромицин | 0,5 х 2 | 7 | 89 | 62 | 22 | Мокси>Клар Мокси=ЦА |
Burke T. et al. (1999) | Острый | 223 | Моксифлоксацин | 0,4 х 1 | 10 | 90 | – | 37*** | ? |
ДС, МЦ | синусит | 234 | Цефуроксим аксетил | 0,5 х 2 | 10 | 89 | – | 26 | ? |
Baz M. | Острый | 253 | Моксифлоксацин | 0,4 х 1 | 10 | 88 | – | 33 | Мокси=Трова |
ДС, МЦ | синусит | 260 | Тровафлоксацин | 0,2 х 1 | 10 | 89 | – | 37 | ? |
| ДС — двойное слепое; МЦ — многоцентровое; О — открытое; КЭ — клиническая эффективность; БЭ — бактериологическая эффективность;* — связанные с препаратом; ** — частота одинаковая, цифры не приводятся; *** — различия достоверны (р<0,05). | |||||||||
Внебольничная пневмония.
Клиническая эффективность моксифлоксацина изучена в 3 сравнительных и 1 несравнительном исследованиях (одно из сравнительных исследований проведено в России как часть международного многоцентрового исследования). Клиническая эффективность моксифлоксацина при внебольничной пневмонии была одинаковой с таковой амоксициллина (3 г в сутки) и кларитромицина (1 г в сутки) — 93–95%, при этом эрадикация возбудителей на фоне применения моксифлоксацина достигнута у 89–94% больных. В одном исследовании (Hoffken G. et al.,1999) бактериологическая эффективность моксифлоксацина была достоверно выше таковой кларитромицина. При метаанализе результатов этих исследований отмечено, что эрадикация S. aureus и H.influenzae под влиянием моксифлоксацина составила 100%, S.pneumoniae и M.catarrhalis — 94%, K.pneumoniae — 89% (Balfour J.A., Wiseman L.R., 1999). Переносимость моксифлоксацина и препаратов сравнения была одинаковой.
aureus и H.influenzae под влиянием моксифлоксацина составила 100%, S.pneumoniae и M.catarrhalis — 94%, K.pneumoniae — 89% (Balfour J.A., Wiseman L.R., 1999). Переносимость моксифлоксацина и препаратов сравнения была одинаковой.
Обострение хронического бронхита.
Действие моксифлоксацина изучено в двух сравнительных исследованиях. Отмечена одинаковая клиническая эффективность моксифлоксацина в течение 5 дней и кларитромицина в течение 7 или 10 дней. Клиническая эффективность моксифлоксацина составила 89–91%, бактериологическая — 77–91%. В одном исследовании бактериологическая эффективность моксифлоксацина оказалась достоверно выше таковой кларитромицина (Wilson R. et al., 1999). При метаанализе результатов этих исследований установлено, что моксифлоксацин превосходит кларитромицин относительно эрадикации H.influenzae (97 и 72% соответственно). Эрадикация S.pneumoniae и M.catarrhalis на фоне применения моксифлоксацина составила 92–100% (Balfour J.A., Wiseman L.R., 1999).
Острый синусит.
В двух сравнительных исследованиях изучено действие моксифлоксацина, цефуроксима аксетила и тровафлоксацина. Отмечена одинаковая клиническая эффективность моксифлоксацина (88–90%) и препаратов сравнения. Данные о бактериологической эффективности препаратов в этих исследованиях не приведены. Переносимость препаратов была удовлетворительной, в одном исследовании частота нежелательных явлений при применении моксифлоксацина была несколько выше таковой цефуроксима аксетила.
Инфекции кожи и мягких тканей.
Результаты трех исследований приведены в тезисах международных конференций. В исследовании L. Parish и соавторов (1999) изучена эффективность моксифлоксацина (по 400 мг каждые 24 ч в течение 7 дней) в сравнении с цефалексином (по 500 мг каждые 8 ч в течение 7 дней) при неосложненных инфекциях кожи и мягких тканей. Клиническая эффективность двух режимов терапии была одинаковой (90 и 91% соответственно), частота нежелательных реакций также не отличалась — 21 и 19%.
В другом исследовании (Del Rosal P.L. et al., 1999) сравнивали эффективность моксифлоксацина (по 200 и 400 мг каждые 24 ч) и цефалексина (по 500 мг каждые 8 ч) при неосложненных инфекциях кожи и мягких тканей. Клиническая эффективность моксифлоксацина в дозе 200 и 400 мг оказалась несколько выше (95 и 100% соответственно) по сравнению с цефалексином — 88,5% (различия недостоверны). Бактериологическая эффективность составила соответственно 72, 80 и 80%.
В работе C. Krasemann и J. Meyer (1999) проанализированы результаты применения моксифлоксацина при стафилококковых инфекциях кожи и мягких тканей; клиническая и бактериологическая эффективность составила 94 и 93% соответственно.
Воспалительные заболевания малого таза (ВЗМТ).
Приведены результаты исследования моксифлоксацина (по 400 мг каждые 24 ч) в сравнении с комбинированной терапией (ципрофлоксацин 500 мг каждые 24 ч + доксициклин 100 мг каждые 12 ч + метронидазол 400 мг каждые 8 ч) при неосложненных ВЗМТ (Heystek M.J. et al.,1999). Эффективность лечения оценена у 434 пациенток. Клиническая эффективность при применении моксифлоксацина составила 97%, в контрольной группе — 98%. Авторы пришли к выводу, что моксифлоксацин так же эффективен при ВЗМТ, как и комбинированный режим терапии.
Приведенные исследования свидетельствуют о высокой клинической эффективности и хорошей переносимости моксифлоксацина при внебольничных инфекциях верхних и нижних дыхательных путей, неосложненных инфекциях кожи и мягких тканей, ВЗМТ.
ДОЗИРОВАНИЕ
АВЕЛОКС применяют внутрь в дозе 400 мг 1 раз в сутки. На основании данных контролируемых исследований установлены оптимальные сроки терапии: 10 дней при внебольничной пневмонии и остром синусите, 5 дней при обострении хронического бронхита. В настоящее время проводятся клинические исследования лекарственной формы моксифлоксацина для внутривенного введения. ?
?
ЗАКЛЮЧЕНИЕ
АВЕЛОКС — препарат нового поколения группы фторхинолонов с широким спектром антимикробного действия, благоприятными фармакокинетическими свойствами, высокой клинической эффективностью при внебольничных инфекциях верхних и нижних дыхательных путей и хорошей переносимостью. Из наиболее важных характеристик моксифлоксацина, отличающих его от более ранних фторхинолонов, следует выделить следующие.
· Более высокая по сравнению с ранними фторхинолонами (ципрофлоксацин, офлоксацин, пефлоксацин) активность in vitro в отношении грамположительных бактерий — пневмококков, стрептококков, стафилококков, а также анаэробов и атипичных внутриклеточных микроорганизмов.
· Высокая активность в отношении пенициллинорезистентных пневмококков и эритромицинорезистентных стрептококков.
· Одинаковая с ранними фторхинолонами активность в отношении грамотрицательных бактерий.
· Наиболее сбалансированный среди всех антибактериальных препаратов спектр активности в отношении возбудителей внебольничных инфекций дыхательных путей.
· Благоприятные фармакокинетические свойства:
— высокая биодоступность, не изменяющаяся при приеме пищи;
— длительный период полувыведения, позволяющий применять препарат 1 раз в сутки;
— хорошее проникновение в жидкости, ткани, альвеолярные макрофаги и нейтрофильные гранулоциты с созданием в них концентраций, превышающих МПК основных возбудителей инфекций дыхательных путей;
— не требуется коррекции режима дозирования у больных пожилого возраста и при нарушении функции почек;
— отсутствие фармакокинетического взаимодействия с циметидином, ранитидином, теофиллином, варфарином.
· Доказанная в контролируемых клинических исследованиях высокая клиническая и бактериологическая эффективность при внебольничной пневмонии, хроническом бронхите, остром синусите.
· Хорошая переносимость, отсутствие фототоксического и гепатотоксического действия, кардиотоксических эффектов (удлинения интервала Q–T, аритмий).
Таким образом, АВЕЛОКС — высокоэффективный инновационный препарат в терапии внебольничных инфекций дыхательных путей — пневмонии, хронического бронхита и острого синусита. Перспективными являются исследования клинической эффективности АВЕЛОКСА при инфекциях кожи и мягких тканей, гинекологических и интраабдоминальных инфекциях, туберкулезе. ?
Статья подготовлена по материалам,
предоставленным представительством компании
«Оникс Фарм» в Украине
Адрес представительства:
04071, Киев, ул. Олеговская, 36
Тел./факс: (044) 417-24-12
E-mail: [email protected]
АВЕЛОКС для інфузій: нові можливості протимікробної терапії
Цікава інформація для Вас:
Ученые СПбГУ разработали антибиотик нового поколения от опасных бактерий
Антибиотики принципиально нового действия, разработанные в СПбГУ, выходят на мировой рынок. Лекарство не только уничтожает большую часть известных опасных бактерий, не повреждая тканей организма, но и усиливает действие других антибиотиков и не позволяет микроорганизмам к ним адаптироваться. Оно успешно борется с различными стафилококками, синегнойной палочкой, кишечной палочкой и другими распространенными среди людей и животных бактериями. В грядущем 2019 году уникальное лекарство на основе личинок мясной мухи появится в аптеках стран Азии, позже препарат начнет использоваться и в России. Разработчики антибиотика уже ведут переговоры об этом с одной из отечественных фармацевтических компаний. Корреспондент Города+ поговорил с руководителем проекта, научным сотрудником кафедры энтомологии СПбГУ Андреем Яковлевым и выяснил подробности.
«Вещества, с которыми мы имеем дело, – это антимикробные пептиды. Это антибиотики естественной природы, которые присутствуют в любом живом организме: от одноклеточного до человека. В том числе они есть и у мух. Интерес состоит в том, что только насекомое в ответ на бактериальную инфекцию вырабатывает сразу несколько таких молекул, их количество может достигать многих сотен», – объясняет ученый.
В том числе они есть и у мух. Интерес состоит в том, что только насекомое в ответ на бактериальную инфекцию вырабатывает сразу несколько таких молекул, их количество может достигать многих сотен», – объясняет ученый.
Проще говоря, у организма мясной мухи более совершенная система защиты от бактерий, чем у человека. Привычный способ лечения для современной медицины – бороться с одной вредной бактерией с помощью одного химического соединения. Вездесущие насекомые оказались предусмотрительнее: их тело вырабатывает целый набор разных соединений, которые адаптируются под любой микроорганизм. Таким образом, у бактерии не остается шансов «раскусить» код антибиотика и защититься от него.
Подобный защитный механизм существует у многих насекомых, но мясная муха – один из самых распространенных их видов, популяцию которого, в отличие от, например, тропического кузнечика, можно легко выращивать в лаборатории. Кроме того, это насекомое живет в предельно негигиеничной и опасной среде, питаясь мертвечиной, и постоянно контактирует с большинством бактерий. То есть, ее иммунную систему можно считать сильной.
Именно поэтому ученые СПбГУ избрали для своей работы такого неприглядного донора. Из личинок мухи они научились добывать те самые естественные белковые антибиотики – пептиды. Многочисленные лабораторные исследования и опыты, по словам Андрея Яковлева, показали невероятный результат. Ни кишечная палочка, ни золотистый стафилококк, ни другие распространенные среди людей и животных бактерии не смогли «привыкнуть» к лекарству даже за месяцы контакта. В конце эксперимента они так же успешно погибали от антибиотика, как и в начале.
«Основная проблема, с которой столкнулась современная медицина, состоит в том, что бактерии со временем вырабатывают устойчивость ко многим антибиотикам. Получается, что мы теряем прежние наработки и вынуждены искать что-то новое или увеличивать дозы. Пептиды же вернут старым лекарствам активность. Этот антибиотик можно и использовать самостоятельно, и комбинировать с другими», – говорит энтомолог.
Кроме того, средство решит вопрос обеззараживания ожогов, язв и других наружных травм. Сегодня при таких заражениях человеку назначают антибиотики в таблетках, потому что очень немногие из них существуют в форме мази. Но внутренние лекарства часто не справляются с задачей. Дело в том, что прошлые поколения антибиотиков способны убивать только активные микроорганизмы. Совсем недавно ученые открыли такое явление как биопленка – особая мембрана на поврежденном участке органа, образуемая скоплением болезнетворных бактерий. Микроорганизм в биопленке иногда находится в спящем состоянии и не распознается антибиотиком.
Для пептидов личинок мухи это не проблема: они уничтожают все угрозы без разбора, не оставляя притаившихся «шпионов», и легко расщепляют пленку. Поэтому их можно наносить на кожу в виде геля или мази, дополняя действие обычного лекарства.
Благодаря всем этим качествам, лекарство имеет потенциал и в медицине, и в ветеринарии. Санкт-Петербургский государственный научно-исследовательский институт особо чистых биопрепаратов провел серию независимых тестов разработки на мышах. Результаты показали, что препарат безвреден и одинаково качественно действует как в организме самой мухи и на лабораторном столе, так и в организме млекопитающего. То есть, его свободно можно использовать для лечения поражений кожи, слизистой системы, внутренних органов и глаз у домашних животных. Но основной интерес, конечно, заключается в возможности лечения таким способом людей.
«Для врача не так важны все эти научные подробности. Для него важно помочь человеку здесь и сейчас. Вот мы с вами разговариваем, а в это самое время врачи заканчивают финальную серию проб – испытывают препарат на нуждающихся в нем людях. Есть все основания ожидать, что результат будет положительным. Сейчас антибиотик на основе антимикробных пептидов регистрируется как препарат лечебного назначения», – делится Андрей Яковлев.
Существующая сейчас лаборатория на базе Санкт-Петербургского государственного университета и малого инновационного предприятия ООО «Энтомед СПбГУ» позволяет производить только 100 тысяч упаковок препарата в год. Дело в том, что для одной дозы антибиотика необходимо целых 100 личинок мясной мухи, и из каждой вещество добывается особым способом при питании насекомого.
Но производство можно расширить, причем в ближайшее время. Проект находится на стыке многих актуальных технических, экологических и биологических проблем. Например, с его помощью можно перерабатывать в уникальное лекарство главный отход птицеводства – куриную кровь. До 10 миллионов тонн этого вещества за ненадобностью уничтожается по достаточно затратной технологии. Лишь малая его часть уходит на разведение кровяных мух, которые используются как пищевая добавка и удобрение.
Андрей Яковлев предлагает птицефабрикам поставлять кровь для конвертации в фармакологические средства. Ведь в основе изготовления нового антибиотика лежит процесс переработки мяса или крови личинками мясной мухи.
По словам ученого, достичь таких заметных результатов и выйти на рынок мухам помог гранд Российского научного фонда. Прорыв в разработке нового антимикробного препарата – это лишь часть большого, поддерживаемого государством проекта. Его цель – создать впоследствии целую биотехнологическую платформу на основе личинок мясных мух для получения самых разных полезных продуктов: это и антибиотики принципиально нового действия, и противовирусные препараты, и компоненты вакцин.
«Благодаря поддержке, мы оказались на новом уровне и шаг за шагом движемся к цели. Все проблемы постепенно решаются, тесты дают результаты, которые не могут не радовать. Азиатские врачи сразу заинтересовались препаратом. Скоро его значимость оценят и в России, уже есть интересующиеся компании, но здесь точные сроки назвать пока сложно», – подытожил генеральный директор малого инновационного предприятия ООО «Энтомед СПбГУ», научный сотрудник кафедры энтомологии СПбГУ Андрей Яковлев.
Поделиться в соцсетях
Разработка антибиотиков нового поколения для снижения устойчивости к антибиотикам
23 сентября, 2019
Читать 3 мин.
ДОБАВИТЬ ТЕМУ В СООБЩЕНИЯ ПО EMAIL
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.Подписывайся
Нам не удалось обработать ваш запрос. Пожалуйста, повторите попытку позже. Если у вас по-прежнему возникает эта проблема, обратитесь по адресу [email protected].
Вернуться в Healio
Устойчивость к противомикробным препаратам или УПП — серьезная проблема общественного здравоохранения. Бактериальные заболевания, которые мы использовали для успешного лечения антибиотиками, вновь превращаются в серьезную угрозу, убивая примерно 700000 человек каждый год, и это число, по прогнозам, достигнет 10 миллионов к 2050 году.Если к тому времени проблема AMR не будет решена, связанные с ней затраты составят примерно 100 триллионов долларов.
В «постантибиотическую эру» супербактерии с множественной лекарственной устойчивостью могут превратиться в массовых убийц и поставить под угрозу другие жизненно важные достижения современной медицины, включая хирургию, трансплантацию органов и химиотерапию рака.
Составленный ВОЗ список приоритетных патогенов, представляющих наибольшую угрозу для здоровья человека, включает несколько семейств бактерий, вызывающих критические инфекции в больницах ( Acinetobacter, Pseudomonas и различные Enterobacteriaceae), а также более распространенные заболевания, такие как пищевое отравление, вызванное Сальмонелла .
Фарох Дотивала
Другие болезни не были включены в список, потому что они уже представляют собой глобальные приоритеты, оказывающие особенно серьезное воздействие на страны с более низким уровнем доходов. В 2017 году зарегистрировано 460 тысяч новых случаев туберкулеза с множественной лекарственной устойчивостью.
Хотя селективное давление, вызванное чрезмерным или ненадлежащим использованием противомикробных препаратов в здравоохранении, сельском хозяйстве и сельском хозяйстве, следует винить в появлении УПП, 30-летний пробел в открытии новых классов антибиотиков оставил нас неготовыми к борьбе с ним. супербактерии.
Новые рациональные нестандартные стратегии необходимы, если мы хотим решить одну из самых больших проблем нашей эпохи.
Недавно я был одним из организаторов симпозиума по устойчивости к грамотрицательным бактериям в Институте Вистар, на котором собрались ведущие эксперты в фармацевтической, биотехнологической, правительственной и академической сферах, чтобы поделиться своими последними открытиями, концепциями и инструментами для борьбы с УПП.
В моей лаборатории в Институте Вистар мы разрабатываем новые иммунные антибиотики, которые могут воздействовать на бактерии, а также задействовать иммунную систему для усиления противомикробной активности.
Синергизм между иммунитетом хозяина и антибиотиками является важным фактором в избавлении от устойчивых к антибиотикам бактерий. Плохая презентация антигена позволяет бактериям уклоняться от обнаружения адаптивной иммунной системой, а именно В-клетками и CD4- и CD8-Т-клетками, дольше сохраняться в организме хозяина и, таким образом, иметь более высокие шансы на развитие устойчивости.
Устойчивость к вакцинам исторически не была проблемой. Фактически, в то время как противомикробные препараты избавляют от инфекций, строго нацеливаясь на патогены, вакцины делают это, задействуя иммунную систему, что, в свою очередь, приводит к множественным специфическим для хозяина ответам антител и / или Т-клеток.Множественность механизмов нацеливания на патогены, индуцируемых вакцинами, гарантирует, что по сравнению с противомикробными препаратами требуется больше мутаций для придания устойчивости к вакцинам.
ПЕРЕРЫВ
Следуя этой модели, наша стратегия основана на индукции быстрого местного антибактериального иммунного ответа, который будет синергетически взаимодействовать с активностью по уничтожению патогенов и предотвращать возникновение резистентности.
Клетки-киллеры врожденного иммунитета могут распознавать молекулярные паттерны, связанные с патогенами (PAMP), обнаруживать вторгшиеся патогены и быстро убивать их.Поскольку многие такие PAMP необходимы для нормального роста бактерий и вирулентности, воздействуя на один или несколько путей PAMP в бактериях, наши иммунные антибиотики могут одновременно убивать их, проявляя прямую антибиотическую активность — и делают их более «видимыми» для иммунной системы.
В этой двунаправленной стратегии ингибиторы метаболизма PAMP будут специфически убивать несколько бактерий без токсического воздействия на клетки-хозяева, у которых нет этих бактериальных путей, а также повышать активацию врожденных клеток-киллеров, что приводит к быстрой пролиферации на локальном уровне. место заражения (в течение 6 часов).
Активированные лимфоциты-киллеры вызывают «микроптоз» или запрограммированную гибель клеток у микробов, используя порообразующий пептид гранулизин для проницаемости микробных мембран и доставки гранзимов, которые расщепляют набор бактериальных белков, которые имеют решающее значение для выживания.
Поскольку химические ингибиторы конкретных путей PAMP коммерчески недоступны, мы разработали наши собственные соединения для исследований, подтверждающих концепцию, и использовали компьютерное молекулярное моделирование для проверки миллионов коммерчески доступных соединений на их способность специфически блокировать целевые ферменты.Наиболее многообещающие результаты были подтверждены и дополнительно изучены с целью поиска избранных соединений для перехода к клиническим испытаниям.
Мы подтвердили, что наш прототип молекулы ингибитора специфически подавляет рост грамотрицательных бактерий. Мы также установили, что это ингибирование проявляет свою токсичность, препятствуя дыханию бактерий и разрушая стенку бактериальной клетки.
Важно отметить, что эти эффекты были воспроизведены на клинических изолятах устойчивых к лекарствам бактерий, подтверждая клинический потенциал этих соединений иммунных антибиотиков.
Наконец, наши соединения были эффективны, как и предполагалось, в активации врожденных клеток-киллеров в периферических мононуклеарных клетках человека и в моделях инфекции на гуманизированных мышах.
- Артикул:
- Dotiwala F, et al. Ячейка . 2017; DOI: 10.1016 / j.cell.2017.10.004.
- Кеннеди Д.А., Читать AF. Proc Royal Soc B . 2017; DOI: 10.1098 / rspb.2016.2562.
- О’Нил Дж. Устойчивость к противомикробным препаратам: преодоление кризиса для здоровья и благосостояния наций.Лондон: Обзор устойчивости к противомикробным препаратам; 2014. https://amr-review.org/sites/default/files/AMR%20Review%20Paper%20-%20Tackling%20a%20crisis%20for%20the%20health%20and%20wealth%20of%20nations_1.pdf.
- ВОЗ. Устойчивость к противомикробным препаратам: Глобальный отчет по эпиднадзору, 2014 г. Женева: Всемирная организация здравоохранения; 2014. https://www.who.int/drugresistance/documents/surveillancereport/en/.
- ВОЗ. Глобальный приоритетный список устойчивых к антибиотикам бактерий для руководства исследованиями, открытием и разработкой новых антибиотиков.Женева: Всемирная организация здравоохранения; 2017. https://www.who.int/medicines/publications/global-priority-list-antibiotic-resistant-bacteria/en/.
- ВОЗ. Глобальный доклад о туберкулезе, 2018 г. Женева: Всемирная организация здравоохранения; 2018. https://www.who.int/tb/publications/global_report/en/.
- Для получения дополнительной информации:
- Фарох Дотивала, бакалавр наук, доктор философии, — доцент Центра вакцин и иммунотерапии Института Вистар.
ДОБАВИТЬ ТЕМУ В СООБЩЕНИЯ ПО EMAIL
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.
Подписывайся
Нам не удалось обработать ваш запрос. Пожалуйста, повторите попытку позже.Если у вас по-прежнему возникает эта проблема, обратитесь по адресу [email protected].
Вернуться в Healio
Иммуноантибиотики двойного действия блокируют жизненно важный путь развития бактерий и активируют адаптивный иммунный ответ — ScienceDaily
Ученые института Wistar открыли новый класс соединений, которые уникальным образом сочетают прямое уничтожение антибиотиками всех устойчивых к лекарствам бактериальных патогенов с одновременным их действием. быстрый иммунный ответ для борьбы с устойчивостью к противомикробным препаратам (УПП).Эти находки были опубликованы сегодня в журнале Nature .
Всемирная организация здравоохранения (ВОЗ) объявила УПП одной из 10 основных угроз общественному здоровью человечества в мире. По оценкам, к 2050 году устойчивые к антибиотикам инфекции могут уносить 10 миллионов жизней каждый год и наложить совокупное бремя на мировую экономику в размере 100 триллионов долларов. Список бактерий, которые становятся устойчивыми к лечению всеми доступными вариантами антибиотиков, растет, и в разработке находится несколько новых лекарств, что вызывает острую потребность в новых классах антибиотиков для предотвращения кризисов в области общественного здравоохранения.
«Мы использовали творческую двойную стратегию для разработки новых молекул, которые могут убивать трудноизлечимые инфекции, одновременно усиливая естественный иммунный ответ хозяина», — сказал Фарох Дотивала, MBBS, доктор философии, доцент кафедры вакцин и Центр иммунотерапии и ведущий автор работы по идентификации нового поколения противомикробных препаратов, названных иммуноантибиотиками двойного действия (DAIA).
Существующие антибиотики нацелены на важнейшие бактериальные функции, включая синтез нуклеиновых кислот и белка, построение клеточной мембраны и метаболические пути.Однако бактерии могут приобретать лекарственную устойчивость, изменяя бактериальную мишень, против которой направлен антибиотик, инактивируя лекарства или откачивая их.
«Мы пришли к выводу, что использование иммунной системы для одновременной атаки бактерий на двух разных фронтах затрудняет развитие у них резистентности», — сказал Дотивала.
Он и его коллеги сосредоточились на метаболическом пути, который важен для большинства бактерий, но отсутствует у людей, что делает его идеальной мишенью для разработки антибиотиков.Этот путь, называемый метил-D-эритритолфосфатом (MEP) или немевалонатным путем, отвечает за биосинтез изопреноидов — молекул, необходимых для выживания клеток у большинства патогенных бактерий. Лаборатория нацелена на фермент IspH, важный фермент в биосинтезе изопреноидов, как способ заблокировать этот путь и убить микробы. Учитывая широкое присутствие IspH в бактериальном мире, этот подход может быть нацелен на широкий спектр бактерий.
Исследователи использовали компьютерное моделирование для скрининга нескольких миллионов коммерчески доступных соединений на их способность связываться с ферментом и выбрали наиболее сильные из них, которые ингибируют функцию IspH, в качестве отправной точки для открытия лекарств.
Поскольку ранее доступные ингибиторы IspH не могли проникать через стенку бактериальной клетки, Дотивала сотрудничал с химиком-химиком Wistar Джозефом Сальвино, доктором философии, профессором онкологического центра Института Вистар и соавтором исследования, чтобы идентифицировать и синтезировать новый Молекулы ингибитора IspH, которые смогли проникнуть внутрь бактерий.
Команда продемонстрировала, что ингибиторы IspH стимулировали иммунную систему с более сильной бактериальной активностью и специфичностью, чем лучшие в своем классе антибиотики, при тестировании in vitro на клинических изолятах устойчивых к антибиотикам бактерий, включая широкий спектр патогенных грамотрицательных и грамположительные бактерии.В доклинических моделях грамотрицательной бактериальной инфекции бактерицидные эффекты ингибиторов IspH превосходили традиционные пан-антибиотики. Было показано, что все протестированные соединения нетоксичны для клеток человека.
«Активация иммунитета представляет собой вторую линию атаки стратегии DAIA», — сказал Кумар Сингх, доктор философии, научный сотрудник лаборатории Dotiwala и первый автор исследования.
«Мы считаем, что эта инновационная стратегия DAIA может стать потенциальной вехой в мировой борьбе с УПП, создавая синергию между прямой убивающей способностью антибиотиков и естественной силой иммунной системы», — повторил Дотивала.
Соавторы: Ришаб Шарма, Поли Ади Нараяна Редди, Прашанти Вонтедду, Мэдлин Гуд, Анджана Сундарраджан, Хери Чой, Кар Мутумани, Эндрю Коссенков, Аарон Р. Голдман, Син-Яо Тан, Джоэл Кассель, Морин Э. Мерфи, Раджасха Сомасундарам и Минхард Херлин из Вистара; и Максим Тотров из ООО «Молсофт».
Работа поддержана: Фондом Дж. Гарольда и Лейлы Ю. Мазерс, средствами Программы Содружества по расширению универсальных исследований (CURE) и Фондом научных открытий Вистар; Благотворительный фонд Pew Charitable Trusts поддержал Фароха Дотивалу грантом института Вистар для трудоустройства; Дополнительную поддержку оказали Фонд медицинских исследований Адельсона и Министерство обороны.Поддержка помещений Института Вистар была предоставлена грантом поддержки онкологических центров P30 CA010815 и инструментальным грантом S10 OD023586 Национальных институтов здравоохранения.
Антибиотики нового поколения, эндолизины бактериофагов и наноматериалы для борьбы с патогенами
Cascales, E., Buchanan, S.K, Duché, D., Kleanthous, C., Lloubès, R., et al. (2007) Биология колицина, Microbiol. Мол. Биол. Ред. , 71 , 158-229, DOI:
https://doi.org/10.1128/MMBR.00036-06.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Сполдинг, К. Н., Кляйн, Р. Д., Руэр, С., Кау, А. Л., Шрайбер, Х. Л. и др. (2017) Селективное истощение уропатогенных E. coli из кишечника антагонистом FimH, Nature , 546 , 528-532, DOI:
https://doi.org/10.1038/nature22972.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Каттуар, В., и Фелден, Б. (2019) Будущие антибактериальные стратегии: от основных концепций до клинических проблем, J. Infect. Дис. , 220 , 350-360, DOI:
https://doi.org/10.1093/infdis/jiz134.
Артикул
PubMed
Google Scholar
Hesse, S., and Adhya, S. (2019) Фаговая терапия в двадцать первом веке: столкновение с упадком эры антибиотиков; наконец-то настало время эпохи фага? Annu. Ред.Microbiol. , 73 , 155-174, DOI:
https://doi.org/10.1146/annurev-micro-0-062535.
CAS
Статья
PubMed
Google Scholar
Hör, J., Matera, G., Vogel, J., Gottesman, S., Storz, G. (2020) Транс-действующие малые РНК и их влияние на экспрессию генов в Escherichia coli и Salmonella enterica , EcoSal Plus , 9 , doi:
https://doi.org/10.1128 / ecosalplus.ESP-0030-2019.
Артикул
Google Scholar
Горски, С. А., Фогель, Дж., И Дудна, Дж. А. (2017) Распознавание и нацеливание на основе РНК: посев семян специфичности, Nat. Rev. Mol. Cell Biol. , 18 , 215-228, DOI:
https://doi.org/10.1038/nrm.2016.174.
CAS
Статья
PubMed
Google Scholar
Гольтерманн, Л., Yavari, N., Zhang, M., Ghosal, A., and Nielsen, P.E. (2019) Ограничение длины ПНК антибактериальной активности конъюгатов пептид-ПНК в Escherichia coli за счет воздействия внутренней мембраны, Front. Microbiol. , 10 , 1032, DOI:
https://doi.org/10.3389/fmicb.2019.01032.
Артикул
PubMed
PubMed Central
Google Scholar
Нусс, А.М., Бекстетт, М., Пименова, М., Шмюль, К., Opitz, W., Pisano, F., Heroven, A.K., and Dersch, P. (2017) Двойная РНК-последовательность тканей позволяет быстро обнаруживать специфичные для инфекции функции и риборегуляторы, формирующие транскриптомы патоген-хозяин, Proc. Natl. Акад. Sci. США , 114 , E791-E800, DOI:
https://doi.org/10.1073/pnas.1613405114.
CAS
Статья
PubMed
Google Scholar
Меламед С., Адамс П. П., Чжан А., Чжан Х. и Сторц Г.(2020) РНК-РНК-интерактомы ProQ и Hfq обнаруживают перекрывающиеся и конкурирующие роли, Mol. Ячейка , 77 , 411-425.e7, doi:
https://doi.org/10.1016/j.molcel.2019.10.022.
CAS
Статья
PubMed
Google Scholar
Xue, XY, Mao, XG, Zhou, Y., Chen, Z., Hu, Y., Hou, Z., Li, M.-K., Meng, J.-R., и Луо, X.-X. (2018) Достижения в области доставки антисмысловых олигонуклеотидов для борьбы с бактериальными инфекционными заболеваниями, Nanomedicine , 14 , 745-758, DOI:
https: // doi.org / 10.1016 / j.nano.2017.12.026.
CAS
Статья
PubMed
Google Scholar
Jayaraman, K., McParland, K., Miller, P., and Ts’o, PO (1981) Селективное ингибирование синтеза и роста белка Escherichia coli неионными олигонуклеотидами, комплементарными 3′-концу 16S рРНК, Proc. Natl. Акад. Sci. США , 78 , 1537-1541, DOI:
https://doi.org/10.1073/pnas.78.3.1537.
CAS
Статья
PubMed
Google Scholar
Отправитель, R., Fuchs, S., and Milo, R. (2016) Пересмотренные оценки количества клеток человека и бактерий в организме, PLoS Biol. , 14 , e1002533, DOI:
https://doi.org/10.1371/journal.pbio.1002533.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Daly, SM, Sturge, CR, Marshall-Batty, KR, Felder-Scott, CF, Jain, R., Geller, BL, and Greenberg , DE (2018) Антисмысловые ингибиторы сохраняют активность в легочных моделях Burkholderia инфекции, ACS Infect.Дис. , 4 , 806-814, DOI:
https://doi.org/10.1021/acsinfecdis.7b00235.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Hoekzema, M., Romilly, C., Holmqvist, E., and Wagner, EGH (2019) Hfq-зависимое развертывание мРНК способствует основанному на мРНК ингибированию трансляции, EMBO J. , 38 , e101199, DOI:
https://doi.org/10.15252/embj.2018101199.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Каннайя, С., Ливни Дж. И Амстер-Чодер О. (2019) Пространственно-временная организация транскриптома E. coli : независимость трансляции и участие в регуляции, Mol. Ячейка , 76 , 574-589.e7, doi:
https://doi.org/10.1016/j.molcel.2019.08.013.
CAS
Статья
PubMed
Google Scholar
Барковски, Г., Лемстер, А. Л., Папеш, Р., Якоб, А., Крюгер, С., Шредер, А., Крайкемейер, Б., and Patenge, N. (2019) Влияние различных проникающих в клетки пептидов на антимикробную эффективность ПНК у Streptococcus pyogenes , Mol. Ther. Нуклеиновые кислоты , 18 , 444-454, DOI:
https://doi.org/10.1016/j.omtn.2019.09.010.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Ли, Х. Дж. (2019) Связь микробов с хозяевами посредством малых РНК во внеклеточных везикулах: транспортные средства для транспортировки РНК транскингдома, Int.J. Mol. Sci. , 20 , 1487, DOI:
https://doi.org/10.3390/ijms20061487.
CAS
Статья
PubMed Central
Google Scholar
Hansen, AM, Bonke, G., Larsen, CJ, Yavari, N., Nielsen, PE, and Franzyk, H. (2016) Конъюгаты антибактериального пептида нуклеиновая кислота-антимикробный пептид (PNA-AMP): антисмысловые нацеливание на биосинтез жирных кислот, Bioconjug. Chem. , 27 , 863-867, DOI:
https: // doi.org / 10.1021 / acs.bioconjchem.6b00013.
CAS
Статья
PubMed
Google Scholar
Bernheim, A. G., Libis, V. K., Lindner, A. B., and Wintermute, E. H. (2016) Фаг-опосредованная доставка целевых конструкций мРНК для подавления экспрессии генов в E. coli , J. Vis. Exp. , 109 , 53618, DOI:
https://doi.org/10.3791/53618.
CAS
Статья
Google Scholar
Балабан, Н.Q., Helaine, S., Lewis, K., Ackermann, M., Aldridge, B., Andersson, D. I., and Zinkernagel, A. (2019) Определения и руководящие принципы для исследований устойчивости антибиотиков, Nat. Rev. Microbiol. , 17 , 441-448, DOI:
https://doi.org/10.1038/s41579-019-0196-3.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Кунин, Е. В., Макарова, К. С., и Чжан, Ф. (2017) Разнообразие, классификация и эволюция систем CRISPR-Cas, Curr.Opin. Microbiol. , 37 , 67-78, DOI:
https://doi.org/10.1016/j.mib.2017.05.008.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Грин, А.С. (2018) Антибактериальные средства на основе CRISPR: преобразование бактериальной защиты в нападение, Trends Biotechnol. , 36 , 127-130, DOI:
https://doi.org/10.1016/j.tibtech.2017.10.021.
CAS
Статья
PubMed
Google Scholar
Бикард, Д., and Barrangou, R. (2017) Использование систем CRISPR-Cas в качестве противомикробных препаратов, Curr. Opin. Microbiol. , 37 , 155-160, DOI:
https://doi.org/10.1016/j.mib.2017.08.005.
CAS
Статья
PubMed
Google Scholar
Циторик, Р. Дж., Мими, М., и Лу, Т. К. (2014) Последовательно-специфические противомикробные препараты с использованием эффективно доставляемых РНК-управляемых нуклеаз, Nat. Biotechnol. , 32 , 1141-1145, DOI:
https: // doi.org / 10.1038 / nbt.3011.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Йосеф И., Мэнор М., Киро Р. и Кимрон У. (2015) Умеренные и литические бактериофаги, запрограммированные на сенсибилизацию и уничтожение устойчивых к антибиотикам бактерий, Proc. Natl. Акад. Sci. США , 112 , 7267-7272, DOI:
https://doi.org/10.1073/pnas.1500107112.
CAS
Статья
PubMed
Google Scholar
Parmeciano Di Noto, G., Молина, М. К., и Кирога, К. (2019) Взгляд на некодирующие РНК как новые противомикробные препараты, Front. Genet. , 10 , 57, DOI:
https://doi.org/10.3389/fgene.2019.00057.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Райт, Г. Д. (2016) Адъюванты антибиотиков: спасение антибиотиков от устойчивости, Trends Microbiol. , 24 , 862, DOI:
https: // doi.org / 10.1016 / j.tim.2016.07.008.
CAS
Статья
PubMed
Google Scholar
Tooke, CL, Hinchliffe, P., Bragginton, EC, Colenso, CK, Hirvonen, VHA, Takebayashi, Y., and Spencer, J. (2019) β-лактамазы и ингибиторы β-лактамаз в 21-м столетие, J. Mol. Биол. , 431 , 3472-3500, DOI:
https://doi.org/10.1016/j.jmb.2019.04.002.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Папп-Уоллес, К.М. (2019) Последние достижения в области комбинаций ингибиторов β-лактам / β-лактамаз для лечения грамотрицательных бактериальных инфекций, Expert. Opin. Фармакотер. , 20 , 2169-2184, DOI:
https://doi.org/10.1080/14656566.2019.1660772.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Эманн, Д. Э., Яхич, К. Х., Росс, П. Л., Гу, Р.-Ф., Ху, Дж., Керн, Г., Уолкап, Г. К., и Фишер, С.L. (2012) Авибактам — ковалентный обратимый ингибитор бета-лактамазы, не являющийся β-лактамным, Proc. Natl. Акад. Sci. США , 109 , 11663-11668, DOI:
https://doi.org/10.1073/pnas.1205073109.
Артикул
PubMed
Google Scholar
Жанель Г. Г., Лоуренс К. К., Адам Х., Швейцер Ф., Зеленицкий С. и др. (2018) Имипенем-релебактам и меропенем-ваборбактам: две новые комбинации ингибиторов карбапенема-β-лактамазы, Drugs , 78 , 65-98, DOI:
https: // doi.org / 10.1007 / s40265-017-0851-9.
CAS
Статья
PubMed
Google Scholar
Салли, Э. К., Геллер, Б. Л., Ли, Л., Муди, К. М., Бейли, С. М. и др. (2017) Пептид-конъюгированный морфолиноолигомер фосфородиамидата (PPMO) восстанавливает восприимчивость карбапенема к NDM-1-позитивным патогенам in vitro и in vivo , J. Antimicrob. Chemother. , 72 , 782-790, DOI:
https: // doi.org / 10.1093 / jac / dkw476.
CAS
Статья
PubMed
Google Scholar
Мо, Ю., Лоренцо, М., Фергали, С., Каур, К., и Хаусман, С. Т. (2019) Что нового в лечении грамнегативных инфекций с множественной лекарственной устойчивостью? Диагн. Microbiol. Заразить. Дис. , 93 , 171-181, DOI:
https://doi.org/10.1016/j.diagmicrobio.2018.08.007.
CAS
Статья
PubMed
Google Scholar
Тран, Х.T., Solnier, J., Pferschy-Wenzig, E.M., Kunert, O., Martin, L., et al. (2020) Антимикробная активность и ингибирующая активность оттока карвотацетонами из Sphaeranthus africanus против микобактерий, Антибиотики (Базель) , 9 , 390, doi:
https://doi.org/10.3390/antibiotics
90.
CAS
Статья
Google Scholar
Осей Секьере, Дж. И Амоако, Д. Г. (2017) Карбонилцианид м-хлорфенилгидразин (CCCP) обращает устойчивость к колистину, но не к карбапенемам и тигециклину, у Enterobacteriaceae с множественной лекарственной устойчивостью, Front.Microbiol. , 8 , 228, DOI:
https://doi.org/10.3389/fmicb.2017.00228.
Артикул
PubMed
PubMed Central
Google Scholar
Негаш, К. Х., Норрис, Дж. К. С. и Ходжкинсон, Дж. Т. (2019) Дизайн конъюгата сидерофор-антибиотик: новые лекарства от вредных клопов? Молекулы , 24 , 3314, DOI:
https://doi.org/10.3390/molecules24183314.
CAS
Статья
PubMed Central
Google Scholar
Тонзилло, Г., Караффа, Э., Пинчера, Б., Граната, Г., и Петросилло, Н. (2019) Настоящее и будущее терапевтических и диагностических подходов на основе сидерофоров при инфекционных заболеваниях, Infect. Дис. Репутация , 11 , DOI:
https://doi.org/10.4081/idr.2019.8208.
Артикул
Google Scholar
Нгуен, Л.П., Пинто, Н.А., Ву, Т.Н., Ли, Х., Чо, Ю.Л., Бьюн, Дж.-Х., Д’Суза, Р., и Йонг, Д. (2020) In vitro активность нового сидерофор-цефалоспорина, GT-1 и ингибитора β-лактамазы серинового типа, GT-055, против Escherichia coli , Klebsiella pneumonia и Acinetobacter spp.панельные штаммы, Антибиотики (Базель) , 9 , 267, doi:
https://doi.org/10.3390/antibiotics67.
CAS
Статья
Google Scholar
Тернбулл, А.Л., и Суретт, М.Г. (2008) L-цистеин необходим для индуцированной устойчивости к антибиотикам у активно роящихся Salmonella enterica серовар Typhimurium , Microbiology , 154 , 3410-3419, doi :
https: // doi.org / 10.1099 / mic.0.2008 / 020347-0.
CAS
Статья
PubMed
Google Scholar
Huber, A., Hajdu, D., Bratschun-Khan, D., Gáspári, Z., Varbanov, M., Philippot, S., et al. (2018) Новый антимикробный потенциал и структурные свойства PAFB: катионный, богатый цистеином белок из Penicillium chrysogenum Q176 , Sci. Реп. , 8 , 1751, DOI:
https://doi.org/10.1038/s41598-018-20002-2.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Тернбулл А. Л. и Суретт М. Г. (2010) Биосинтез цистеина, окислительный стресс и устойчивость к антибиотикам у Salmonella typhimurium, , Res. Microbiol. , 161 , 643-650, DOI:
https://doi.org/10.1016/j.resmic.2010.06.004.
CAS
Статья
PubMed
Google Scholar
Чен, Х.L., Su, P.Y., Kuo, S.C., Lauderdale, T.Y., and Shih, C. (2018) Добавление C-концевого цистеина (CTC) может усилить бактерицидную активность трех различных антимикробных пептидов, Front. Microbiol. , 9 , 1440, DOI:
https://doi.org/10.3389/fmicb.2018.01440.
Артикул
PubMed
PubMed Central
Google Scholar
Fontes, L. E. S., Martimbianco, A. L. C., Zanin, C., and Riera, R. (2019) N-ацетилцистеин в качестве адъювантной терапии для эрадикации Helicobacter pylori , Cochrane Database Syst.Ред. , 2 , CD012357, doi:
https://doi.org/10.1002/14651858.CD012357.pub2.
Артикул
PubMed
Google Scholar
Schütz, C. и Empting, M. (2018) Ориентация на систему определения кворума хинолонов Pseudomonas для открытия новых антиинфекционных патоблокаторов, Beilstein J. Org. Chem. , 14 , 2627-2645, DOI:
https://doi.org/10.3762/bjoc.14.241.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Оверхэдж, Дж., Campisano, A., Bains, M., Torfs, E.C W., Rehm, B.H.A., и Hancock, R.E. W. (2008) Пептид защиты хозяина человека LL-37 предотвращает образование бактериальной биопленки, Infect. Иммун. , 76 , 4176-4182, DOI:
https://doi.org/10.1128/iai.00318-08.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Reffuveille, F., de la Fuente-Núñez, C., Mansour, S., and Hancock, R. E. W. (2014) Пептид антибиотикопленки широкого спектра действия усиливает действие антибиотика против бактериальных биопленок, Antimicrob.Агенты Chemother. , 58 , 5363-5371, DOI:
https://doi.org/10.1128/aac.03163-14.
Артикул
PubMed
PubMed Central
Google Scholar
Бранкатисано, Флорида, Майзетта, Г., Ди Лука, М., Эсин, С., Боттаи, Д., Биззарри, Р., Кампа, М., и Батони, Г. (2014) Ингибирующий эффект антимикробного пептида гепсидина 20, полученного из печени человека, на биопленках полисахаридного межклеточного адгезина (PIA) -положительных и PIA-отрицательных штаммов Staphylococcus epidermidis , Biofouling , 30 , 435-446, doi:
https: // doi.org / 10.1080 / 08927014.2014.888062.
CAS
Статья
PubMed
Google Scholar
Плетцер Д., Колман С. Р. и Хэнкок Р. Э. (2016) Пептиды против биопленки как новое оружие в противомикробной войне, Curr. Opin. Microbiol. , 33 , 35-40, DOI:
https://doi.org/10.1016/j.mib.2016.05.016.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Рибес, С., Adam, N., Ebert, S., Regen, T., Bunkowski, S., Hanisch, U.-K., and Nau, R. (2010) Вирусный агонист TLR3 poly (I: C) стимулирует фагоцитоз и внутриклеточное уничтожение Escherichia coli микроглиальными клетками, Neurosci. Lett. , 482 , 17-20, DOI:
https://doi.org/10.1016/j.neulet.2010.06.078.
CAS
Статья
PubMed
Google Scholar
Мата-Аро, В., Чекич, К., Мартин, М., Чилтон, П.M., Casella, C.R., и Mitchell, T.C. (2007) вакцинный адъювантный монофосфориллипид A как TRIF-смещенный агонист TLR4, Science , 316 , 1628-1632, doi:
https://doi.org/10.1126/science.1138963.
CAS
Статья
PubMed
Google Scholar
Хуарес, Э., Карранса, К., Эрнандес-Санчес, Ф., Леон-Контрерас, Дж. К., Эрнандес-Пандо, Р. и др. (2012) NOD2 усиливает врожденный ответ альвеолярных макрофагов на Mycobacterium tuberculosis у людей, Eur.J. Immunol. , 42 , 880-889, DOI:
https://doi.org/10.1002/eji.201142105.
CAS
Статья
PubMed
Google Scholar
Gorityala, BK, Guchhait, G., Goswami, S., Fernando, DM, Kumar, A., Zhanel, GG, and Schweizer, F. (2016) Гибридный антибиотик преодолевает устойчивость у P. aeruginosa путем увеличения проникновения через внешнюю мембрану и уменьшения оттока, J. Med. Chem. , 59 , 8441-8455, DOI:
https: // doi.org / 10.1021 / acs.jmedchem.6b00867.
CAS
Статья
PubMed
Google Scholar
Laselva, O., Stone, TA, Bear, CE и Deber, CM (2020) Антиинфекционные средства восстанавливают ORKAMBI ® , спасая функцию F508del-CFTR в эпителиальных клетках бронхов человека, инфицированных клиническими штаммами P. aeruginosa , Биомолекулы , 10 , 334, doi:
https://doi.org/10.3390/biom10020334.
CAS
Статья
PubMed Central
Google Scholar
Малахова, Н., and DeLeo, F. R. (2010) Мобильные генетические элементы Staphylococcus aureus , Cell. Мол. Life Sci. , 67 , 3057-3071, DOI:
https://doi.org/10.1007/s00018-010-0389-4.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Джеймс, Г.А., Своггер, Э., Уолкотт, Р., Пульчини, Э., Секор, П., Сестрих, Дж., Костертон, Дж. У. и Стюарт, П.С. (2008) Биопленки в хронических ранах. Wound Rep.Regen. , 16 , 37-44, DOI:
https://doi.org/10.1111/j.1524-475X.2007.00321.x.
Артикул
Google Scholar
Леймер, Н., Рахмуль, К., Палейрос Маркес, М., Бальманн, А.С., Фуррер, А. и др. (2016) Нестабильный Staphylococcus aureus вариантов малых колоний индуцируются низким pH и сенсибилизируются к антимикробной терапии путем фаголизосомального подщелачивания, J. Infect. Дис. , 213 , 305-313, DOI:
https: // doi.org / 10.1093 / infdis / jiv388.
CAS
Статья
PubMed
Google Scholar
Нельсон, Д. К., Шмельчер, М., Родригес-Рубио, Л., Клумп, Дж., Притчард, Д. Г., Донг, С., и Донован, Д. М. (2012) Эндолизины как противомикробные препараты, Adv. Virus Res. , 83 , 299-365, DOI:
https://doi.org/10.1016/B978-0-12-394438-2.00007-4.
CAS
Статья
PubMed
Google Scholar
Накамура Т., Китана, Дж., Фуджики, Дж., Такасе, М., Иори, К., Симоике, К., и Ивано, Х. (2020) Литическая активность поливалентного стафилококкового бактериофага PhiSA012 и его эндолизина Lys-PhiSA012 против антибиотика- клинические изоляты резистентных стафилококков из участков кожной инфекции собак, Front. Med. , 7 , 234, DOI:
https://doi.org/10.3389/fmed.2020.00234.
Артикул
Google Scholar
Шмельхер М., Донован Д.M., and Loessner, M.J. (2012) Эндолизины бактериофагов как новые противомикробные средства, Future Microbiol. , 7 , 1147-1171, DOI:
https://doi.org/10.2217/fmb.12.97.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Герстманс, Х., Криел, Б., и Бриерс, Ю. (2018) Синтетическая биология модульных эндолизинов, Biotechnol. Adv. , 36 , 624-640, DOI:
https://doi.org/10.1016 / j.biotechadv.2017.12.009.
CAS
Статья
PubMed
Google Scholar
Schmelcher, M., Tchang, V. S. и Loessner, M. J. (2011) Перестановка доменов и модульная инженерия фаговых эндолизинов Listeria для повышения литической активности и сродства связывания, Microb. Biotechnol. , 4 , 651-662, DOI:
https://doi.org/10.1111/j.1751-7915.2011.00263.x.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Беккер, С.К., Фостер-Фрей, Дж. И Донован, Д. М. (2008) Литический фермент фага K LysK и лизостафин действуют синергетически, убивая MRSA, FEMS Microbiol. Lett. , 287 , 185-191, DOI:
https://doi.org/10.1111/j.1574-6968.2008.01308.x.
CAS
Статья
PubMed
Google Scholar
Gutierrez, D., Fernandez, L., Martinez, B., Ruas-Madiedo, P., Garcia, P., and Rodriguez, A. (2017) Оценка биопленки Staphylococcus aureus в реальном времени разрушение белками фагового происхождения, Front.Microbiol. , 8 , 1632, DOI:
https://doi.org/10.3389/fmicb.2017.01632.
Артикул
PubMed
PubMed Central
Google Scholar
Freitas, AI, Vasconcelos, C., Vilanova, M., and Cerca, N. (2014) Оптимизация системы автоматического подсчета для количественного определения Staphylococcus epidermidis клеток в биопленках, J. Basic Microbiol. . , 54 , 750-757, DOI:
https: // doi.org / 10.1002 / jobm.201200603.
Артикул
PubMed
Google Scholar
Melo, LDR, Brandão, A., Akturk, E., Santos, SB, and Azeredo, J. (2018) Характеристика нового кайвируса Staphylococcus aureus , содержащего лизин, активный против биопленок, вирусов , 10 , 182, DOI:
https://doi.org/10.3390/v10040182.
CAS
Статья
PubMed Central
Google Scholar
Гутьеррес, Д., Руас-Мадиедо, П., Мартинес, Б., Родригес, А., и Гарсия, П. (2014) Эффективное удаление стафилококковых биопленок эндолизином LysH5, PLoS One , 9 , e107307, doi:
https://doi.org/10.1371/journal.pone.0107307.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Каплан, Дж. Б. (2011) Образование биопленок, индуцированное антибиотиками, Int. J. Artif. Органы , 34 , 737-751, DOI:
https: // doi.org / 10.5301 / ijao.5000027.
CAS
Статья
PubMed
Google Scholar
Фишетти В.А. (2008) Лизины бактериофагов как эффективные антибактериальные средства, Curr. Opin. Microbiol. , 11 , 393-400, DOI:
https://doi.org/10.1016/j.mib.2008.09.012.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Шен Ю., Баррос М., Веннеманн Т., Галлахер Д. Т., Инь Ю. и др. (2016) Эндолизин бактериофага, который уничтожает внутриклеточные стрептококки, Elife , 5 , e13152, doi:
https://doi.org/10.7554/eLife.13152.
Артикул
PubMed
PubMed Central
Google Scholar
Röhrig, C., Huemer, M., Lorge, D., Luterbacher, S., Phothaworn, P., et al. (2020) Нацеленность на скрытые патогены: проникающие в клетки ферменты уничтожают внутриклеточную лекарственную устойчивость Staphylococcus aureus , mBio , 11 , e00209-20, doi:
https: // doi.org / 10.1128 / mBio.00209-20.
Артикул
PubMed
PubMed Central
Google Scholar
Olsen, NMC, Thiran, E., Hasler, T., Vanzieleghem, T., Belibasakis, GN, Mahillon, J., Loessner, MJ, and Schmelcher, M. (2018) Синергетическое удаление статических и динамические Staphylococcus aureus биопленки путем комбинированной обработки эндолизином бактериофага и полисахаридной деполимеразой, Вирусы , 10 , 438, doi:
https: // doi.org / 10.3390 / v10080438.
CAS
Статья
PubMed Central
Google Scholar
Hjelm, LC, Nilvebrant, J., Nygren, PA, Nilsson, AS, and Seijsing, J. (2019) Лизис стафилококковых клеток модульными доменами лизина, связанными через нековалентный мост взаимодействия барназа-барстар, Фронт. Microbiol. , 10 , 558, DOI:
https://doi.org/10.3389/fmicb.2019.00558.
Артикул
PubMed
PubMed Central
Google Scholar
Вербри, К.T., Datwyler, SM, Meile, S., Eichenseher, F., Donovan, DM, Loessner, MJ, and Schmelcher, M. (2017) Исправлено и переиздано: идентификация конструкций пептидогликангидролазы с синергетической стафилолитической активностью в коровьем молоке. , заявл. Environ. Microbiol. , 84 , e02134-17, DOI:
https://doi.org/10.1128/AEM.02134-17.
Артикул
PubMed
PubMed Central
Google Scholar
Тхуккарам, М., Cools, P., Nikiforov, A., Rigole, P., Coenye, T., et al. (2020) Антибактериальная активность пористого покрытия TiO2, легированного серебром, на титановых подложках, синтезированных методом плазменного электролитического окисления, заявл. Прибой. Sci. , 500 , 144235, DOI:
https://doi.org/10.1016/j.apsusc.2019.144235.
CAS
Статья
Google Scholar
Пономарев В.А., Орлов Е.А., Маликов Н.А., Тарасов Ю.В., Шевейко А.N., et al. (2020) Украшенные наночастицами Ag (Pt) биоактивные, но антибактериальные покрытия TiO, легированные Ca и P 2 , полученные плазменным электролитическим окислением и ионной имплантацией, Appl. Прибой. Sci. , 516 , 146068, DOI:
https://doi.org/10.1016/j.apsusc.2020.146068.
CAS
Статья
Google Scholar
Фельдман, М. Д., Петерсен, А. Дж., Карлинер, Л. С., и Тайс, Дж. А. (2008) Кто отвечает за оценку безопасности и эффективности медицинских устройств? Роль независимой оценки технологий, J.Gen. Intern. Med. , 23 , 57-63, DOI:
https://doi.org/10.1007/s11606-007-0275-4.
Артикул
PubMed
Google Scholar
Макинтайр, У. Ф. и Хили, Дж. С. (2017) Инфекции имплантируемых электронных устройств в сердце: от распознавания риска к профилактике, Heart Rhythm. , 14 , 846-847, DOI:
https://doi.org/10.1016/j.hrthm.2017.03.027.
Артикул
PubMed
Google Scholar
Андерсен, О.З., Офферманнс В., Силлассен М., Альмтофт К. П., Андерсен И. Х. и др. (2013) Ускоренный рост кости за счет местной доставки стронция из титановых имплантатов с функционализированной поверхностью, Биоматериалы , 34 , 5883-5890, DOI:
https://doi.org/10.1016/j.biomaterials.2013.04.031.
CAS
Статья
PubMed
Google Scholar
Arciola, C. R., Campoccia, D., and Montanaro, L. (2018) Инфекции имплантатов: адгезия, образование биопленок и уклонение от иммунитета, Nat.Rev. Microbiol. , 16 , 397-409, DOI:
https://doi.org/10.1038/s41579-018-0019-y.
CAS
Статья
PubMed
Google Scholar
Mukherjee, K., Acharya, K., Biswas, A., and Jana, NR (2020) TiO 2 наночастиц, совместно допированных азотом и фтором в качестве активированных видимым светом противогрибковых агентов, ACS Appl. . Nano Mater. , 3 , 2016-2025, DOI:
https://doi.org/10.1021/acsanm.0c00108.
CAS
Статья
Google Scholar
Атай Х. Ю., Челик Э. (2017) Исследования антибактериальной активности хитозана в полимерных композиционных покрытиях, Prog. Орг. Пальто. , 102 , 194-200, DOI:
https://doi.org/10.1016/j.porgcoat.2016.10.013.
CAS
Статья
Google Scholar
Сухорукова И.В., Шевейко А.Н., Швиндина Н. В., Житняк И. Ю., Глушанкова Н. А. и др. (2017) Подходы к контролируемому высвобождению ионов Ag + : влияние топографии поверхности, шероховатости и содержания бактерицидов, ACS Appl. Матер. Интерфейсы , 9 , 4259-4271, doi:
https://doi.org/10.1021/acsami.6b15096.
CAS
Статья
PubMed
Google Scholar
Калмантаева О.В., Фирстова В.В., Грищенко Н.С., Рудницкая Т.И., Потапов В.Д., Игнатов С.Г. (2020) Антибактериальная и иммуномодулирующая активность наночастиц серебра в моделях туберкулеза на экспериментальных мышах, Appl. Biochem. Microbiol. , 56 , 226-232, DOI:
https://doi.org/10.1134/S0003683820020088.
CAS
Статья
Google Scholar
Weng, Q., Wang, X., Bando, Y., and Golberg, D. (2016) Функционализированные наноматериалы гексагонального нитрида бора: новые свойства и применения, Chem.Soc. Ред. , 45 , 3989-4012, DOI:
https://doi.org/10.1039/C5CS00869G.
CAS
Статья
PubMed
Google Scholar
Эманет, М., Сен, О., Ташкин, И.., И Шулха, М. (2019) Синтез, функционализация и био-приложения двумерных наноматериалов нитрида бора, Front. Bioeng. Biotechnol. , 7 , 363, DOI:
https://doi.org/10.3389/fbioe.2019.00363.
Артикул
PubMed
PubMed Central
Google Scholar
Хан, А., Li, X., Huang, B., Tsoi, JK-H., Matinlinna, JP, Chen, Z., and Deng, DM (2016) Влияние модификации поверхности титанового имплантата на динамический процесс начальной микробной адгезии и образование биопленок, Int. J. Adhes. Клеи. , 69 , 125-132.
CAS
Статья
Google Scholar
Huang, H., Chang, Y., Lai, M., Lin, C., Lai, C., and Shieh, T. (2010) Антибактериальные покрытия TaN-Ag на титановых зубных имплантатах, Surf .Пальто. Technol. , 205 , 1636-1641, DOI:
https://doi.org/10.1016/j.surfcoat.2010.07.096.
CAS
Статья
Google Scholar
Сухорукова И.В., Шевейко А.Н., Кирюханцев-Корнеев Ф.В., Анисимова Н.Ю., Глушанкова Н.А., Житняк И.Ю., Бенесова Дж., Амлер Э., Штанский В.Д. (2015 г.) ) Два подхода к формированию антибактериальной поверхности: легирование бактерицидным элементом и загрузка лекарственного средства, заявл.Прибой. Sci. , 330 , 339-350, DOI:
https://doi.org/10.1016/j.apsusc.2014.12.119.
CAS
Статья
Google Scholar
Карвальо, И., Энрикес, М., Оливейра, Дж. К., Алвес, CFA, Пьедаде, А. П. и Карвалью, С. (2013) Влияние поверхностных характеристик на адгезию Staphylococcus epidermidis к Ag− Тонкие пленки TiCN, Sci. Technol. Adv. Матер. , 14 , 035009, DOI:
https: // doi.org / 10.1088 / 1468-6996 / 14/3/035009.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Бай, Л. (2015) Наноструктурированные покрытия титан-серебро с хорошей антибактериальной активностью и цитосовместимостью, полученные одностадийным магнетронным распылением, Appl. Прибой. Sci. , 355 , 32-44, DOI:
https://doi.org/10.1016/j.apsusc.2015.07.064.
CAS
Статья
Google Scholar
Коци, К., Матею, К., Обалова, Л., Крейчикова, С., Лачны, З .., Плача, Д., Чапек, Л., Хосподкова, А., Сольцова, О. (2010) Влияние легирования серебром на TiO 2 для фотокаталитического восстановления CO 2 , Прил. Catalysis B Environ. , 96 , 239-244, DOI:
https://doi.org/10.1016/j.apcatb.2010.02.030.
CAS
Статья
Google Scholar
Cloutier, M., Mantovani, D., and Rosei, F. (2015) Антибактериальные покрытия: проблемы, перспективы и возможности, Trends Biotechnol., 33 , 637-652, DOI:
https://doi.org/10.1016/j.tibtech.2015.09.002.
CAS
Статья
PubMed
Google Scholar
Гао, Ю., Чыонг, Ю. Б., Чжу, Ю., и Киратзис, И. Л. (2014) Антибактериальные нановолокна с электропрядением: производство, активность и применения in vivo , J. Appl. Polym. Sci. , 131 , 9041-9053, DOI:
https://doi.org/10.1002/app.40797.
CAS
Статья
Google Scholar
Монтейро, Н., Мартинс, М., Мартинс, А., Фонсека, Н. А., Морейра, Дж. Н., Рейс, Р. Л., и Невес, Н. М. (2015) Антибактериальная активность хитозановых сеток из нановолокон с липосомами, иммобилизованными и высвобождающими гентамицин, Acta Biomater. , 18 , 196-205, DOI:
https://doi.org/10.1016/j.actbio.2015.02.018.
CAS
Статья
PubMed
Google Scholar
Пермякова Е.С., Полчак Ю., Слукин П.В., Игнатов С.Г., Глушанкова Н.A., et al. (2018) Антибактериальные биосовместимые нановолокна PCL, модифицированные полимерами плазмы COOH-ангидрида и иммобилизацией гентамицина, Materials Design , 153 , 60-70, DOI:
https://doi.org/10.1016/j.matdes.2018.05.002.
CAS
Статья
Google Scholar
Yaqoob, A. A., Ahmad, H., Parveen, T., Ahmad, A., Oves, M., et al. (2020) Последние достижения в области наноматериалов, украшенных металлом, и их различных биологических приложений: обзор, Front.Chem. , 8 , DOI:
https://doi.org/10.3389/fchem.2020.00341.
Google Scholar
Пономарев В.А., Шевейко А.Н., Пермякова Е.С., Ли Дж., Воеводин А.А. и др. (2019) Наночастицы на основе Pt и Fe, поддерживаемые TiCaPCON, и связанная с ними антибактериальная активность, ACS Appl. Матер. Интерфейсы , 11 , 28699-28719, doi:
https://doi.org/10.1021/acsami.9b09649.
CAS
Статья
PubMed
Google Scholar
Сарди, Дж.CO, Scorzoni, L., Bernardi, T., Fusco-Almeida, AM, и Giannini, MJSM (2013) Candida видов: текущая эпидемиология, патогенность, образование биопленок, природные противогрибковые продукты и новые терапевтические возможности, J. Med. . Microbiol. , 62 , 10-24, doi:
https://doi.org/10.1099/jmm.0.045054-0.
CAS
Статья
PubMed
Google Scholar
Сухорукова И.В., Шевейко А.Н., Манахов А., Житняк И. Ю., Глушанкова Н. А. и др. (2018) Синергетический и длительный антибактериальный эффект пленок TiCaPCON-Ag с антибиотиками против патогенных бактерий и грибов, Mater. Sci. Англ. C , 90 , 289-299, DOI:
https://doi.org/10.1016/j.msec.2018.04.068.
CAS
Статья
Google Scholar
Сараева И.Н., Толордава Э.Р., Настулявичус А.А., Иванова А.К., Кудряшов С.I., et al. (2020) Бактериальный мизерикорд: кремниевые нанобритвы с лазерной генерацией со встроенными биотоксичными наночастицами борются с образованием прочных биопленок, Laser Phys. Lett. , 17 , DOI:
https://doi.org/10.1088/1612-202x/ab5fca.
Артикул
Google Scholar
Объединение усилий для создания нового поколения антибиотиков
Антибиотики — одно из величайших достижений медицины.Для большинства бактериальных инфекций доступны дешевые и эффективные антибиотики. Однако многие назначаются до того, как станет известен возбудитель инфекции. Хотя это часто делается не зря, это привело к злоупотреблению антибиотиками во всем мире. Хотя резистентные инфекции по-прежнему составляют меньшинство, они представляют собой растущую проблему и, по прогнозам, станут серьезным бременем для здоровья во всем мире в ближайшем будущем. Evotec понимает проблемы, связанные с бактериями с множественной лекарственной устойчивостью, и поддерживает открытие и разработку противоинфекционных препаратов, от идентификации цели до клинической стадии.
Какие проблемы стоят перед компаниями, разрабатывающими новые антибиотики?
Понятно, что нам срочно нужны инновационные антибиотики. Однако у компаний не было достаточных экономических стимулов для разработки новых противоинфекционных препаратов. Стоимость вывода лекарства на рынок высока, и, особенно в отношении антибиотиков, нет никаких обещаний по окупаемости инвестиций. В отличие от других лекарств, лечение антибиотиками, как правило, представляет собой короткие курсы продолжительностью от 5 до 15 дней, после которых пациент обычно выздоравливает.Более того, любые новые лекарства, скорее всего, будут использоваться только при устойчивых инфекциях. Это означает, что изначально продажи могут быть низкими. Разработчики лекарств уходят с поля. Текущая экономическая модель нуждается в развитии.
Существуют ли какие-либо новые экономические модели для поддержки развития?
Растет число новых механизмов финансирования, которые дают «толчок» разработчикам лекарств. Несколько финансирующих организаций, в том числе CARB-X, BARDA, Novo REPAIR Impact Fund, Глобальное партнерство по исследованиям и разработкам антибиотиков (GARDP) и Европейская инициатива в области инновационных лекарственных средств (IMI), всецело привержены открытию и разработке антибиотиков.Глобальные регулирующие органы, в том числе Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США и Европейское агентство по лекарственным средствам, также оказывают «толчок», улучшая нормативно-правовую базу, позволяя подавать заявки на одобрение на основе небольших клинических испытаний. Агентства также помогли с планированием испытаний и оценкой клинической ценности, что делает разработку проще, дешевле и быстрее без ущерба для качества. Вся эта поддержка важна и эффективно стимулирует новые открытия.Однако с 1962 года было одобрено только два новых класса антибиотиков. Нам нужны новые классы антибиотиков, новые мишени и новые механизмы действия.
Разработка антибиотиков имеет «толчки», а как насчет «тяги»?
Необходимо срочно решить проблему поощрения притяжения. Было введено несколько стимулов, таких как Закон GAIN в США и предложения о передаче исключительных прав или финансовых вознаграждений компаниям, успешно продвигающим новый антибиотик.Другие предлагаемые подходы включают отключение объемов антибиотиков от продаж, обеспечение возврата инвестиций без стимулирования ненужных рецептов и чрезмерного использования. Не все из этих решений были реализованы, но есть попытки их решить. Evotec является частью мирового сообщества, работающего над тем, чтобы это произошло. Мы уверены, что будет найдено решение, которое принесет пациенту столь необходимые новые методы лечения и обеспечит устойчивую бизнес-модель.
Чем может помочь Evotec?
Существует глобальная тенденция к аутсорсингу НИОКР.Это особенно важно в области терапии инфекционных заболеваний, поскольку все большее число фармацевтических и биотехнологических компаний нуждаются в доступе к опыту для внедрения инноваций и разработки новых антибиотиков. Evotec применяет совместный подход к исследованиям и разработкам в области противоинфекционных средств и создала открытую платформу инноваций для быстрой и рентабельной разработки новых противоинфекционных средств. Что наиболее важно, у нас есть глубокие знания о бактериальных инфекциях, включая лекарственно-устойчивый туберкулез. Наша команда и платформа поддерживают наших партнеров от идентификации цели до исследований, обеспечивающих поддержку IND, и разработки клинических стадий.У нас самое большое количество преданных своему делу ученых-инфекционистов в частном секторе, которые вместе со многими партнерами разрабатывают новые антибиотики, а также помогают сохранять критически важный опыт и обучать новых ученых. В дополнение к нашему предложению интегрированных услуг мы также работаем в области рисков и партнерство с разделением вознаграждения, при котором мы совместно владеем продуктами, а также разрабатываем собственные.
А как насчет самых ранних проектов?
Наша модель BRIDGE (биомедицинские исследования, инновации и эффективность развития) является связующим звеном между академическим сообществом и фармацевтической промышленностью.Партнерские отношения BRIDGE служат инкубатором и помогают академическим исследователям получать важные данные, проверять процессы и финансовый опыт, необходимые инвесторам. У нас также есть новое партнерство с Центром исследований инфекций им. Гельмгольца, основанное на работе Рольфа Мюллера над новым классом широкого спектра грамотрицательные антибиотики. Второе партнерство с GARDP может стать в высшей степени стратегическим и направлено на обеспечение совместных инвестиций в понимание и борьбу с устойчивостью к противомикробным препаратам.В Evotec мы постоянно стремимся способствовать изменениям и гордимся тем, что находимся в авангарде исследований и разработок в области антиинфекционных препаратов.
Наша цель — разработка антибиотиков нового поколения
Чтобы помочь предотвратить резистентность, новые антибиотики, созданные сегодня, часто хранятся в резерве и используются редко. А когда они используются, пациентам требуется лишь короткий курс лечения бактериальных инфекций. Это резко контрастирует с лечением многих хронических заболеваний, от которых пациентам часто необходимо принимать лекарства всю жизнь.Все это означает, что фармацевтические компании не стремятся окупать свои затраты на исследования и разработку этих лекарств.
В июле 2019 года мы приветствовали испытание в Великобритании системы оплаты по подписке для фармацевтических компаний, чтобы стимулировать создание новых антибиотиков. Мы считаем, что обязательство правительства Великобритании протестировать эту новую модель оплаты для поддержки исследований и разработок в области антибиотиков может изменить правила игры, и мы надеемся, что другие страны последуют примеру Великобритании.
Сотрудничество в области открытия и разработки новых лекарств
Мы не справимся в одиночку.
Исследования антибиотиков — одна из областей, в которой мы считаем ключевым моментом более непредвзятый подход к обмену информацией и партнерство с экспертами за пределами наших лабораторий. Вот почему мы были первой компанией, которая внедрила подход государственно-частного партнерства к исследованиям и разработкам в области антибактериальных средств, работая с финансирующими организациями как в Европе, так и в США, чтобы помочь устранить некоторые из основных препятствий на пути открытия и разработки новых лекарств.
Некоторые из этих партнерств включают Управление передовых биомедицинских исследований и разработок правительства США (BARDA) и Агентство по снижению оборонных угроз (DTRA) с целью поддержки разработки нескольких антибиотиков для борьбы с устойчивостью к антибиотикам и биотерроризмом.
Мы хотим, чтобы больше компаний занялись этой областью, чтобы работать с нами, чтобы помочь в разработке нового поколения антибиотиков. Для этого нам нужно решить финансовую загадку, которая удерживает критически важные инвестиции в этой области.
Мы постоянно говорим о необходимости перемен, и нас очень воодушевляет количество других компаний, государственных и неправительственных организаций, действующих в этой сфере, которые продемонстрировали готовность объединиться для разработки новых схем оплаты антибиотиков. , которые вознаграждают компании за их инвестиции и инновации.
Благодаря сочетанию нашего собственного опыта и умных, совместных и инновационных методов работы мы убеждены, что можем разработать новые инновационные способы борьбы с бактериями, чтобы защитить здоровье человека для будущих поколений.
Антибиотики нового поколения, разработанные для борьбы с устойчивостью
Устойчивость к антибиотикам была названа Всемирной организацией здравоохранения (ВОЗ) одной из самых больших угроз для глобального здоровья, даже с антибиотиками «последней линии», которые используются в качестве последней защиты от сопротивление, неэффективное в некоторых случаях.
Спрос на новые методы лечения высок, поскольку национальные регулирующие органы, такие как Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), поощряют разработку методов лечения. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов даже вмешалось в дебаты о возмещении расходов на антибиотики, чтобы предположить, что необходимо будет найти новую модель, чтобы стимулировать научно-исследовательские работы в фармацевтической промышленности.
Несколько крупных фармацевтических компаний недавно покинули рынок, в том числе Novartis и AstraZeneca, сделав разработку новых антибиотиков зависимой от более мелких компаний.
Манос Перрос, генеральный директор Entasis
Одной из таких компаний является Entasis Therapeutics, которая отделилась от AstraZeneca в 2015 году и в этом году вступает в фазу III испытаний своего главного кандидата, ETX2514SUL. In-PharmaTechnologist ( IPT ) поговорил с генеральным директором компании Маносом Перросом ( MP ) о будущем развития антибиотиков и о том, что может побудить крупные фармацевтические компании вернуться в космос.
ИПТ: Как используются современные антибиотики?
MP: Вы лечите инфекцию по органам и размеру тела, часто не зная, какой патоген вы на самом деле пытаетесь убить.Это сработало, это сработало какое-то время, потому что у нас были последовательные волны антибиотиков, которые были бы эффективны против насекомых, которые развивают устойчивость к предыдущей линии.
ИПТ: Как это способствует развитию устойчивости к антибиотикам?
MP: Устойчивость возникает, когда вы широко применяете антибиотики, патогены довольно быстро развивают резистентность — чем больше вы их используете, тем быстрее развивается резистентность. Мы были в мире, где антибиотики прописывают миллионам пациентов — вы бы изобрели одно лекарство, и вы могли бы использовать его для лечения ушной инфекции, инфекции мочевыводящих путей или инфекции стопы одним и тем же лекарством.Это дает вам очень широкое применение, а также быстрое появление сопротивления. Другая вещь, которую это дает вам, — это бизнес-модель с низкой рентабельностью и большими объемами, которая на самом деле является тем, как антибиотики продавались всегда. У этой модели есть и обратные стороны, особенно когда у вас заканчиваются новые лекарства, после того, как вы сорвали низко висящие плоды, как это сделали мы, и вы доходите до того момента, когда становится все труднее найти новые эффективные и безопасные лекарства. Вот где мы находимся сегодня.
IPT: Что происходит, когда возникает сопротивление?
Сегодня у вас есть несколько пациентов, и, по нашим оценкам, в США ежегодно происходит около 200 000 инфекций, которые обладают множественной лекарственной устойчивостью.Это означает, что несколько линий антибиотиков не работают сегодня у пациентов, которые лечатся тем, что мы называем терапией спасения — это лекарства, которые существуют уже несколько десятилетий, токсичны и полностью переносятся, но на самом деле являются единственным вариантом для многих пациентов. Иногда вы можете спасти жизнь пациента, а иногда нет. Часто пациенты покидают больницу с побочными эффектами, сохраняющимися на всю жизнь.
IPT: Как Entasis пытается остановить рост устойчивости к антибиотикам?
MP: Способ, которым мы создали Entasis, на самом деле немного отличается и выглядит для работы в мире, где большинство пациентов будут лечить недорогими непатентованными лекарствами.Для тех немногих пациентов, для которых эти лекарства больше не действуют, они будут лечиться новыми антибиотиками, которые будут нацелены на патогены и будут разработаны для лечения устойчивых к лекарствам инфекций с хорошей эффективностью и переносимостью. Это та молекула, над которой мы работаем в Entasis.
IPT: Entasis эффективно работает над созданием резервов антибиотиков нового поколения?
MP: Верно. Резервы — это один из способов описать это, а управление — другой.Многие из наших коллег будут жаловаться на то, что они открыли наркотики, которые потом кладут на полку. Это третий способ сказать то же самое. Мы принимаем это, я думаю, что это правильный способ использования таких лекарств, потому что вы хотите использовать их только тогда, когда они вам нужны — для пациентов, которых нельзя лечить недорогими непатентованными лекарствами. Когда безопасные непатентованные антибиотики, которые спасают 95% пациентов, не работают, вы обращаетесь к вам и используете новое лекарство, специально предназначенное для борьбы с устойчивыми патогенами.Вот как это сделать.
IPT: Как Entasis обнаруживает и развивает свой конвейер?
MP: Прежде всего, вам нужно изобрести эти лекарства, и вместо того, чтобы проводить кампании по скринингу и искать вещества в почве, например, мы фактически идентифицируем патоген и создаем молекулы, которые нацелены на эту специфическую устойчивость. Например, наша ведущая программа — ETX2514SUL, которая нацелена на заражение Acinetobacter . Для нас первый шаг — определить, есть ли у Acinetobacter медицинская необходимость, понять резистентность, в этом случае резистентность обусловлена классом β-лактамаз, а затем разработать молекулу, которая будет решать эту проблему резистентности. .Для ETX2514SUL молекула является ингибитором β-лактамазы. Итак, это первый шаг — идентификация патогенов и второй шаг — очень конкретный дизайн молекулы.
Шаг третий — разработать его целенаправленно, и именно здесь все становится интересно, потому что, если вы хотите разработать лекарство от пневмонии или кожной инфекции, очень часто вам нужно проводить крупные клинические испытания. Пациенты, которые не очень хорошо типизированы, это пациенты с пневмонией, которые могут быть инфицированы одним из дюжины или около того патогенов, и поэтому вам нужно большое количество.FDA попросит вас провести два испытания фазы III, потому что данные не очень однородны. Однако мы нацелены на пациентов — мы ищем пациентов, у которых есть только лекарственно-устойчивые инфекции. Таким образом, теперь вы можете разработать гораздо более целенаправленное исследование с пациентами, которые гораздо более однородны по способу воздействия инфекции на них, и вы получите четкий сигнал с меньшими числами. Мы собираемся начать фазу III для гораздо меньшего количества пациентов, а это значит, что вы доберетесь до пациентов быстрее и с меньшими затратами.
IPT: Какая модель будет после утверждения молекулы?
MP: Вот где вы смотрите на другую модель — вместо модели с низкой маржой и большим объемом она становится моделью с высокой маржой и низкой стоимостью, потому что вы используете антибиотик у гораздо меньшего числа пациентов. в цифрах почти как болезнь. Это мало чем отличается от онкологии, где у вас была химиотерапия для каждого пациента от рака груди, а в настоящее время вы фактически вводите рак и адаптируете лечение к пациенту.Итак, это наше видение рынка антибиотиков будущего: дженерики для большинства пациентов, а для тех, у кого это не сработает, вы получите целевые антибиотики по более высокой цене.
IPT: переходят ли разговоры такого типа к плательщикам?
MP: Я химик, и там, где мы находимся сейчас, как компания, занимающаяся клинической стадией, в этом году мы переходим к Фазе III — так что нам еще предстоит проделать путь. Мы начинаем взаимодействовать с плательщиками и проводим обсуждения с отдельными лицами с ключевыми заинтересованными сторонами.Я думаю о медицинском обслуживании, и с точки зрения затрат это на самом деле лучший подход, чем проводить недели в больнице. В случае заражения Acinetobacter уровень лекарственной устойчивости в США, который является одним из самых низких в мире, составляет около 50%, и 50% из этих пациентов умрут при сегодняшних стандартах лечения. Из тех, кто не умирает, они могут оставаться в больнице в течение трех или четырех недель в отделении интенсивной терапии, так что лечение не только спасет жизни пациентов, но и вы сэкономите деньги системы здравоохранения.
IPT: Многие крупные компании отказались от этого пространства, как вы видите это изменение?
MP: Я думаю, что когда у нас будет изменяющаяся среда, от большого объема, низкой прибыли до низкого объема, высокой маржи, меньшие компании будут стимулировать изменения. Я думаю, что по мере того, как мы выходим в этот новый мир и у нас есть несколько методов лечения, которые работают по-новому и действительно приносят прибыль, я думаю, что большая фармацевтика вернется. Это бизнес-решение, которое по большей части вытеснило из космоса более крупные компании.Я думаю, это демонстрация жизнеспособности бизнес-модели, которая вернет крупную фармацевтику.
Манос Перрос занимал должность генерального директора, соучредителя и директора Entasis Therapeutics с мая 2015 года. До этого Перрос работал в компании AstraZeneca вице-президентом и руководителем отдела исследования инфекций и раннего развития с 2010 по 2015 год.
Отслеживание глобального конвейера разрабатываемых антибиотиков
Эта записка более не актуальна. Смотрите последние данные здесь.
Лекарственно-устойчивые бактерии или супербактерии представляют серьезную и все более серьезную угрозу для здоровья человека. Согласно отчету Центров по контролю и профилактике заболеваний, 2,8 миллиона американцев ежегодно заражаются серьезными инфекциями, вызванными устойчивыми к антибиотикам бактериями, и в результате 35000 из них умирают. Врачи обычно встречают пациентов с инфекциями, которые не поддаются лечению, и когда на рынке появляются новые лекарства, у бактерий может быстро развиться резистентность. Чтобы обеспечить поступление новых антибиотиков в ногу с этими развивающимися патогенами, необходимо иметь надежный поток новых лекарств и инновационные способы доставки этого лекарства пациентам, которые в нем больше всего нуждаются.
Разработка новых лекарств требует много времени, усилий, научных исследований и затрат. Исторические данные показывают, что, как правило, только 1 из 5 лекарств от инфекционных заболеваний, которые достигают начальной фазы тестирования на людях, получит одобрение Управления по контролю за продуктами и лекарствами (FDA). Разработка антибиотиков для лечения высокорезистентных бактериальных инфекций является особенно сложной задачей, поскольку лишь небольшое число пациентов заражаются этими инфекциями и отвечают требованиям для участия в традиционных клинических испытаниях.
Чтобы пролить свет на ассортимент антибиотиков, оценить государственную политику и отслеживать потенциальное воздействие на общественное здоровье, благотворительный фонд Pew Charitable Trusts провел оценку антибиотиков, находящихся в клинической разработке. Список, который обновляется ежегодно, идентифицирует каждое лекарство, производителя, потенциальные цели и этап в процессе разработки. (См. Методологию критериев, используемых для выбора лекарств.)
Выводы
Текущая оценка конвейера показывает, что в разработке находится 41 новый антибиотик.Эти препараты потенциально могут воздействовать на многие, но не на все резистентные бактерии. Однако, учитывая неизбежность того, что некоторые из этих антибиотиков не получат одобрения и что в конечном итоге у них разовьется резистентность к одобренным, очевидно, что в разработке находится слишком мало лекарств для удовлетворения текущих и ожидаемых потребностей пациентов. По состоянию на декабрь 2019 г .:
- Из 41 разрабатываемого антибиотика 15 находились в фазе 1 клинических испытаний, 12 — в фазе 2, 13 — в фазе 3, на один была подана заявка на новый препарат, четыре были одобрены.Исторически сложилось так, что около 60 процентов лекарств, которые входят в Фазу 3, будут одобрены. (Описание каждой фазы см. В глоссарии терминов.)
- По крайней мере 18 антибиотиков, находящихся в клинической разработке, обладают потенциалом для лечения инфекций, вызванных грамотрицательными возбудителями ESKAPE, — критическая область неудовлетворенной потребности. Инфекции, вызываемые этими патогенами, не только трудно вылечить, но и найти новые методы лечения для преодоления грамотрицательной резистентности также особенно сложно. И из них, по крайней мере, 13 обладают потенциальной активностью против устойчивых к карбапенемам / продуцирующих β-лактамаз расширенного спектра действия Enterobacteriaceae, Acinetobacter baumannii и Pseudomonas aeruginosa , патогенов, которые Всемирная организация здравоохранения (ВОЗ) считает серьезными угрозами, поскольку они устойчивы ко всем или почти ко всем антибиотикам, доступным сегодня.
- Кроме того, по крайней мере 10 антибиотиков, если они будут одобрены, могут лечить инфекции, вызванные лекарственно-устойчивыми Neisseria gonorrhoeae или Clostridioides difficile (ранее известными как Clostridium difficile ), которые CDC считает острой угрозой для здоровья населения .
- Примерно каждый четвертый препарат, находящийся в разработке, представляет собой новый класс или механизм действия. Ни один из них не является потенциально активным в отношении грамотрицательных возбудителей ESKAPE или патогенов критической угрозы ВОЗ, и почти половина новых продуктов находится в разработке для C.difficile.
- Из примерно 35 компаний, в которых антибиотики находятся в стадии клинической разработки, только одна входит в число 50 крупнейших фармацевтических компаний по объему продаж. Более 95 процентов разрабатываемых сегодня продуктов изучаются небольшими компаниями, а не крупными фармацевтическими фирмами, которые когда-то доминировали в этой области. Кроме того, почти 75 процентов компаний считаются недополученными, что означает, что у них нет продуктов на рынке.
Решения
Pew и другие организации, изучающие проблему устойчивости к антибиотикам, выступают за политику, направленную на решение научных, нормативных и экономических проблем при разработке новых антибиотиков.Эти усилия направлены на то, чтобы подготовить трубопровод к разнообразным потенциальным методам лечения, которые имеют наилучшие шансы добраться до пациентов.
Pew поддержал одобрение Закона «О создании антибиотиков сейчас» (GAIN) для стимулирования разработки новых антибиотиков. Закон повысил коммерческую ценность антибиотиков, предназначенных для лечения серьезных или опасных для жизни инфекций, обозначенных как квалифицированные препараты для лечения инфекционных заболеваний (QIDP), за счет увеличения срока, в течение которого лекарства могут продаваться без конкуренции с генерическими лекарствами, на пять лет.Лекарства, которые получают пользу от GAIN, сейчас находятся в разработке.
Регулирующим усовершенствованием является введение антибактериальных препаратов для ограниченного населения (LPAD), разрешенное в Законе о лечении 21 века, которое предоставит FDA уникальный механизм для рассмотрения и утверждения новых антибиотиков специально для использования у пациентов с неудовлетворенными медицинскими потребностями. Этот процесс сделает разработку наиболее необходимых антибиотиков более осуществимой при сохранении стандартов безопасности и эффективности FDA.
Сильный трубопровод также требует целенаправленных усилий для стимулирования фундаментальных научных исследований и поощрения сотрудничества между академическим сообществом и промышленностью.Pew работает с ключевыми заинтересованными сторонами, чтобы определить способы эффективного решения важнейших научных приоритетов при открытии новых антибиотиков. Чтобы решить эту ключевую задачу, Pew запустил Общую платформу для исследований и знаний об антибиотиках (SPARK), облачную виртуальную лабораторию, которая позволяет ученым обмениваться данными и знаниями, извлекать уроки из прошлых исследований и генерировать новые идеи о том, как молекулы входят и оставаться внутри грамотрицательных бактерий.
Методология
Первоначальный список антибиотиков, находящихся в клинической разработке, был предоставлен Citeline Inc.Служба разведки наркотиков компании Pharmaprojects.
Ассортимент включает антибиотики, предназначенные для лечения серьезных инфекций, которые действуют системно или на весь организм, но не включает препараты местного действия, такие как местные, офтальмологические и ингаляционные препараты. Он также не включает новые показания или различные составы для ранее одобренных лекарств и лекарств, используемых для лечения микобактериальных инфекций, таких как туберкулез, Mycobacterium avium complex, Helicobacter pylori и возбудителей биологических болезней.Мы не включаем нетрадиционные кандидаты, такие как вакцины, антитела и пробиотики, в этот конвейер (для них см. Наш нетрадиционный набор). Антибиотики, выпуск которых прекращен, можно увидеть в инструменте визуализации конвейера.
Также в разработку включены средства для лечения инфекций C. difficile , многие из которых действуют локально в кишечнике. C. difficile часто является следствием системного применения антибиотиков, и, хотя эти бактерии еще не обладают широкой устойчивостью к антибиотикам, CDC считает этот патоген неотложной угрозой.Тысячи американцев заболевают этой болезнью каждый год, и, по оценкам, в результате умирает около 15000 человек.
Pew дополнил данные, предоставленные Citeline, другой общедоступной информацией, в частности, испытаниями, зарегистрированными в государственных реестрах клинических испытаний (США, https://www.clinicaltrials.gov, Австралийский реестр клинических испытаний Новой Зеландии, http: //www.anzctr .org.au, Регистр клинических испытаний Европейского Союза, https://www.clinicaltrialsregister.eu, Японский фармацевтический информационный центр, http: // www.Clinicaltrials.jp), плакаты и презентации, представленные на конференциях, статьи, опубликованные в научной литературе или отраслевой прессе, а также сообщения компаний. Если никакие испытания не были включены в реестр клинических испытаний, то кандидат будет отмечен с указанием фазы, указанной на веб-сайте компании или предоставленной непосредственно компанией. Утвержденные антибиотики останутся в списке для последующего обновления после утверждения первоначального показания. Антибиотики, разрешенные в стране за пределами США.S., но они все еще находятся в стадии клинической разработки для рынка США, будут отмечены и останутся в разработке.
Pew также работает с внешними экспертами, которые консультируют по определенным определениям, таким как потенциальное влияние лекарств-кандидатов на грамотрицательные патогены. Возбудители ESKAPE включают Enterococcus faecium, Staphylococcus aureus (грамположительные), Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa, и Enterobacter видов (грамотрицательные).К неотложным угрозам CDC относятся C. difficile , устойчивые к карбапенемам Enterobacteriaceae (CRE), устойчивые к карбапенемам Acinetobacter (CRAB) и устойчивые к лекарствам N. gonorrhoeae . Возбудители критических приоритетов ВОЗ включают устойчивые к карбапенемам Acinetobacter baumannii (CRAB), устойчивые к карбапенемам Pseudomonas aeruginosa (CRPA), устойчивые к карбапенемам Enterobacteriaceae (CRE) и бета-лактамазы расширенного спектра (ESBL), продуцирующие Enterobacteriaceae 1 707.
«Да» в столбцах ESKAPE pathogens или CDC срочно / ВОЗ по патогенам критических угроз означает, что лекарство имеет in vitro, и / или in vivo, данные, показывающие активность против соответствующих бактерий. «Возможно» в этих столбцах указывает на кандидата, имеющего информацию о деятельности, сообщенную компанией через корпоративный веб-сайт, выпуск новостей или прямое общение, и / или с неубедительными данными in vitro, / in vivo, . Лекарства с неизвестным парным антибиотиком будут отмечены как таковые, а также могут быть указаны как «возможно», потому что активность неизвестна до тех пор, пока антибиотик не будет подтвержден.
Возможные показания для каждого препарата основаны на клинических испытаниях, которые в настоящее время зарегистрированы в государственном реестре клинических испытаний, и / или на зарегистрированных обозначениях квалифицированных препаратов для лечения инфекционных заболеваний (QIDP), если не указано иное. Как только лекарство будет одобрено, будут сообщены только одобренные показания. Показания в синих кружках — это обозначения QIDP. Обозначение QIDP присваивается FDA антибиотикам, предназначенным для лечения серьезных или опасных для жизни инфекций. QIDP имеют право на получение льгот в соответствии с Законом о создании антибиотиков сейчас (подписанным в рамках Закона о безопасности и инновациях Управления по санитарному надзору за качеством пищевых продуктов и медикаментов), включая ускоренную проверку FDA и расширенные эксклюзивные права на одобренные продукты.
1 Всемирная организация здравоохранения, «ВОЗ публикует список бактерий, для которых срочно необходимы новые антибиотики», пресс-релиз, 27 февраля 2017 г., https://www.who.int/news-room/detail/27- 02-2017-который-публикует-список-бактерий, для которых срочно необходимы новые антибиотики.
Этот трубопровод будет обновляться ежегодно. Чтобы отправить дополнения, обновления или комментарии, свяжитесь с [адрес электронной почты защищен].

 Lancet Infect Dis. 2016; 16: 661-673. https://www.thelancet.com/journals/laninf/article/PIIS1473-3099(16)30004-4/fulltext
Lancet Infect Dis. 2016; 16: 661-673. https://www.thelancet.com/journals/laninf/article/PIIS1473-3099(16)30004-4/fulltext В., Багирова Н.С., Терещенко И.В. Сравнение клинической активности двух оксазолидинов – линезолида и тедизолида: неоправданные ожидания. Сибирский онкологический журнал. 2018; 17 (5): 87–93.
В., Багирова Н.С., Терещенко И.В. Сравнение клинической активности двух оксазолидинов – линезолида и тедизолида: неоправданные ожидания. Сибирский онкологический журнал. 2018; 17 (5): 87–93. И.
И. et al. (2000)
et al. (2000) et al. (1999)
et al. (1999) N. et al. (1999)
N. et al. (1999)